Orencia: Neue Stärken für Kinder
Bristol-Myers Squibb (BMS) hat das Portfolio von Orencia (Abatacept) erweitert: Neben den bisherigen Wirkstärken mit 125 mg und 250 mg ist das Biological nun auch in zwei weiteren Stärken speziell zur Behandlung der polyartikulären juvenilen idiopathischen Arthritis (pJIA) auf dem Markt.
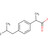
Abatacept ist ein T-Zell-Co-Stimulationsmodulator und zählt zu den Biologika: Er reduziert in Kombination mit Methotrexat (MTX) die Progression der Gelenkschädigung und verbessert die körperliche Funktionsfähigkeit. Bisher stand Abatacept subkutan nur für die Behandlung von Erwachsenen mit Rheumatoider Arthritis zur Verfügung. Nun wurde das Anwendungsgebiet erweitert: Der Wirkstoff ist auch in der Kinderrheumatologie zur subkutanen Applikation in Form einer Fertigspritze verfügbar.
In Kombination mit MTX ist Orencia indiziert für die Behandlung der mäßigen bis schweren aktiven pJIA bei Patienten ab zwei Jahren, die auf eine vorherige Therapie mit krankheitsmodifizierenden Antirheumatika (DMARD) – einschließlich MTX – nicht ausreichend angesprochen haben. Bei Patienten mit einer Intoleranz gegen MTX – oder wenn MTX aus anderen Gründen nicht verabreicht werden darf – kann Orencia auch als Monotherapie sowohl subkutan wie auch intravenös verabreicht werden. Die Fertigspritze bietet die Möglichkeit einer vereinfachten Behandlung zu Hause: Die subkutane Applikation ist in der Indikation pJIA jetzt in den Stärken 50 mg und 87,5 mg auf dem Markt. Ein Vorteil ist, dass die Behandlung ohne intravenöse Aufättigungsdosis begonnen und anschließend gewichtsadaptiert wöchentlich zu Hause wiederholt werden kann.
Ebenso wurde das Anwendungsgebiet für Abatacept in der Stärke à 250 mg als Pulverkonzentrat zur Herstellung einer Infusionslösung erweitert: In Kombination mit MTX ist es jetzt auch zur Behandlung der mäßigen bis schweren aktiven pJIA bei Patienten ab sechs Jahren indiziert, die nicht ausreichend auf eine vorherige DMARD-Therapie, einschließlich MTX, angesprochen haben. Orencia erhielt im Jahr 2010 zunächst nur die Zulassung zur intravenösen Verabreichung von pJIA-Patienten ab sechs Jahren, wenn mindestens ein TNFi versagt hatte. Hintergrund für die jetzige Erweiterung der Anwendung ist die Aufhebung dieser Nutzungsbeschränkung, Abatacept erst nach der unzureichenden Reaktion auf mindestens einen Anti-Tumornekrosefaktor-alpha-Inhibitor (TNFi) einzusetzen.
Die Wirksamkeit und Verträglichkeit von Abatacept bei pJIA sowohl bei subkutaner als auch intravenöser Verabreichung wurde durch zwei Studien belegt:In der multizentrischen, randomisierten, placebokontrollierten, doppelblinden Phase-III-Studie „Awaken“ konnte erstmals die Wirksamkeit und Verträglichkeit von intravenös verabreichtem Abatacept in der pJIA gezeigt werden. Eine zweite multizentrische, offene Phase-III-Studie fand über 24 Monate bei Patienten mit JIA zwischen 2 und 17 Jahren statt, die auf mindestens ein nichtbiologisches oder biologisches DMARD unzureichend angesprochen hatten. Die Wirksamkeit von Abatacept bei Erwachsenen konnte durch die Daten der Studie auf die subkutane Anwendung bei Patienten mit pJIA zwischen 2 und 17 Jahren übertragen werden. Die gute Ansprechrate deckte sich ebenfalls mit den Ergebnissen der Awaken-Studie zur intravenösen Gabe von Abatacept.
Zu den häufigsten Nebenwirkungen von Orencia gehören Kopfschmerzen, Übelkeit, Durchfall, Husten, Fieber und Bauchschmerzen. Während der ersten vier Monate der intravenösen Behandlung wurden insgesamt sechs schwere unerwünschte Ereignisse berichtet, darunter akute lymphatische Leukämie, Ovarialzysten, Infektionen mit dem Varizella-Zoster-Virus, Krankheitsschübe und Gelenkdestruktion. Lokale Reaktionen an der Injektionsstelle traten mit einer Häufigkeit von 4,4 Prozent auf. Desweiteren sind bakterielle und virale Infektionen durch die Immunsuppression möglich. Die neuen Stärken von Orencia sind in Packungen mit jeweils vier Fertigspritzen auf dem Markt.
Die pJIA ist die häufigste Form der Gelenkentzüng im Kindesalter: Es handelt sich um eine Autoimmunerkrankung, die meist chronisch verläuft. Das Immunsystem greift die Gelenkinnenhaut an, wodurch es zu Entzündungen kommt. Diese führen zu Schwellung und vermehrter Flüssigkeitsproduktion im Gelenk. Eine langanhaltende Entzündung beeinträchtigt Knorpel, Knochen, Sehnen und Bänder. In den meisten Fällen sind die Gelenke betroffen, die Krankheit kann jedoch auch die Organe befallen. Die Erkrankung erschwert den Alltag der betroffenen Kinder und kann schließlich zu einer Behinderung führen.






















APOTHEKE ADHOC Debatte