Auseinzeln: BGH sieht kein Grundsatzproblem
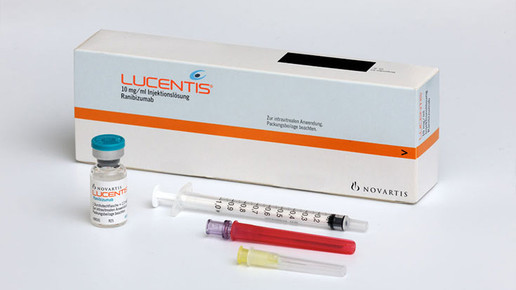
Nach dem EuGH-Urteil zu Defekturen kommt die zweite gute Nachricht für die Herstellung in der Apotheke aus Karlsruhe: Apotheken und Herstellbetriebe dürfen auch in Zukunft bestimmte Medikamente auseinzeln. Der Bundesgerichtshof (BGH) lehnte eine Nichtzulassungsbeschwerde von Novartis ab; der Pharmakonzern war gegen das Umfüllen seines Augenpräparats Lucentis (Ranibizumab) vorgegangen und hatte vor dem Oberlandesgericht Hamburg (OLG) eine Niederlage kassiert.
Lucentis wird von Novartis in Durchstechflaschen mit 0,23 Millilitern Inhalt vertrieben. Für die Behandlung verwenden Ärzte aber nur 0,05 Milliliter – der Rest wird verworfen. Apozyt hatte unter sterilen Bedingungen die für eine Injektion nötige Menge abgefüllt. Auf diese Weise konnten die Therapiekosten deutlich reduziert werden. Novartis vertrat die Ansicht, für die Herstellung von Fertigspritzen benötige Apozyt eine Zulassung, und klagte.
Konkret geht es um das Nebeneinander zweiter EU-Vorgaben: Die EU-Verordnung 726/2004 schreibt vor, dass bestimmte Arzneimittel nur dann in den Verkehr gebracht werden dürfen, wenn dafür eine Genehmigung erteilt wurde. Demgegenüber stehen die EU-Richtlinie zu Humanarzneimitteln 2001/83/EG und das deutsche Apothekengesetz, die Ausnahmen für Rezepturen vorsehen.
Zunächst hatte es gut für Apozyt ausgesehen: Der eingeschaltete Europäische Gerichtshof (EuGH) hatte im April 2013 klargestellt, dass eine Zulassung nicht erforderlich ist, wenn die Umfüllung nicht zu einer Veränderung des Arzneimittels führt und nur auf der Grundlage individueller Verordnungen vorgenommen wird. Die Bewertung des konkreten Falls überließen die Richter in Luxemburg aber den Kollegen in Hamburg.
Das Landgericht (LG) legte den Begriff „Veränderung“ sehr weit aus: Er umfasse neben Änderungen der Substanz oder des Wirkstoffes auch Änderungen bei Dosierung, Darreichungsform, Anwendung und Haltbarkeit, hieß in der Urteilsbegründung. Messen lassen muss sich die Rezepturherstellung demnach an den Vorgaben, die für den Originalhersteller gelten würden.
Novartis hatte in dem Verfahren argumentiert, dass man selbst als Zulassungsinhaber für jede Änderung des zugelassenen Arzneimittels eine erneute Zulassung benötige. Dem waren die Richter am LG noch gefolgt: „Es wäre weder logisch noch verständlich, warum Dritte für Modifikationen, für die selbst der Genehmigungsinhaber einer weiteren Genehmigung bedarf, keinerlei Genehmigung beibringen müssten.“
Die Richter am OLG sahen es anders. Aus ihrer Sicht ist das EuGH-Urteil so zu verstehen, dass sich die Zusammensetzung eines Arzneimittels nicht verändern darf. Dass Änderungen bei der Haltbarkeit oder der Darreichungsform gemeint gewesen seien, konnten die Richter der Entscheidung nicht entnehmen.
Das Urteil ist mit der Abweisung der Beschwerde durch den BGH rechtskräftig, Apozyt darf also Originalspritzen ohne eine entsprechende Zulassung auseinzeln. Wenn das Verfahren anders ausgegangen wäre, hätten Rezepturen aus Fertigarzneimitteln zum Problem für Apotheken werden können. Auch die Antikörper Herceptin (Trastuzumab), MabThera (Rituximab), Avastin (Bevacizumab), Vectibix (Panitumumab) und das Krebsmittel Perjeta (Pertuzumab) sind laut Fachinformation nur zur einmaligen Anwendung zugelassen, werden aber in der Praxis regelmäßig für mehrere Zubereitungen verwendet – entsprechende Krankenkassenverträge schreiben dies sogar vor. Auf diese Weise wird versucht, die Kosten in dem schnell wachsenden Markt niedrig zu halten.
Im Extremfall hätte die Zubereitung komplexer Rezepturen zum grundsätzlichen Problem werden können: Nur wenn der Originalhersteller beispielsweise die Kombination verschiedener Substanzen in der Fachinformation berücksichtigt hat, wäre demnach die Weiterverarbeitung zulässig gewesen. Anderenfalls müsste der Apotheker die Verantwortung übernehmen, also eine Zulassung beantragen oder den Nachweis erbringen, dass sich das Arzneimittel nicht verändert.
Für die Pharmakonzerne wäre es nahe liegend, künftig auf die „einmalige Anwendung“ in der Zulassung zu achten und ein möglichst enges Anwendungsgebiet vorzuschreiben. Womöglich wäre sogar der Gesetzgeber gefragt gewesen: Denn nach den Grundsätzen des ursprünglichen Hamburger Urteils hätte auch die Indikation strikt beachtet werden müssen – und die kennen die Apotheker in der Regel gar nicht.
In einem ähnlichen Fall hatte das LG zuletzt an seiner Argumentation festgehalten und die Auseinzelung verboten. Apotheker Hermann Rohlfs, Inhaber der Privilegierten Rats-Apotheke in Uslar, musste sich gegen Novartis und Bayer verteidigen, weil er nicht nur Lucentis, sondern auch Eylea (Aflibercept) ausgeeinzelt hatte. Er hatte sich darauf bezogen, dass für Rezepturen aus Apotheken keine Zulassung benötigt werde.
Das Urteil steht zwar nach wie vor aus, in der mündlichen Verhandlung machten die Richter jedoch deutlich, dass die EU-Verordnung aus ihrer Sicht keine Ausnahme für Rezepturen vorsieht. Und die vom EuGH formulierte Ausnahme gelte nur, wenn das Arzneimittel nicht verändert werde. Das sei aber der Fall – schon allein, weil sich die Haltbarkeit der Präparate verändere.
Rohlfs wandte in dem Verfahren ein, dass ein Verbot von Zubereitungen aus biotechnologisch hergestellten Fertigarzneimitteln dramatische Folgen hätte, etwa für die Restmengenverwertung im Bereich der Zytostatika. Doch für die Gegenseite war klar, dass in diesem Fall das Sozialgesetz geändert werden müsse. Und die Richter erklärten: „Nicht alles, was die Krankenkassen von den Apothekern verlangen, ist rechtmäßig.“





































APOTHEKE ADHOC Debatte