Zu heiß in der Apotheke: Was passiert mit den Medikamenten?
Nach der kurzzeitigen Schließung der Berliner Hauptbahnhof-Apotheke vergangene Woche stellt sich für Apothekenmitarbeiter die Frage, ob eine Überschreitung der empfohlenen Lagertemperatur zwingend mit negativen Folgen für die Stabilität der Arzneistoffe einhergeht. Sollten Medikamente, die mehrere Stunden oder Tage wärmer als üblich gelagert wurden, an Patienten abgegeben werden?
Seit Wochen schwitzt Deutschland, mancherorts sollen Temperaturen von rund 40 Grad erreicht worden sein. Zu viel für manche Menschen – aber auch für Arzneimittel. Denn aufgrund hoher Temperaturen und hoher Luftfeuchtigkeit können sich die enthaltenen Wirkstoffe zersetzen, die zu einem Wirkungsverlust führen können. Aber auch die Bildung toxischer Zersetzungsprodukten ist möglich. Physikalisch kann es zu Ausfällungen oder zum Schmelzen des Wirkstoffs kommen.
Auch spielt es eine Rolle, ob sie nur kurz oder sehr lang hohen Temperaturen ausgesetzt waren. Die Reaktionsgeschwindigkeit einer Zersetzung hängt unter anderem von der Temperatur ab. Bei einer Temperaturerhöhung um 10 Grad kann sich die Reaktionsgeschwindigkeit verdoppeln bis verdreifachen. Tückisch ist in diesem Zusammenhang, dass Zersetzungen nicht immer sichtbar sein müssen.
Die genannten Folgen können nicht nur bei Wirkstoffen, sondern auch bei Hilfsstoffen auftreten. Beispielsweise können die in Salbengrundlagen enthaltenen Fettsäuren und ätherische Öle temperaturempfindlich sein. Bei hohen Temperaturen kann auch hier die Qualität leiden und es zu einer Phasentrennung kommen. Bei Pflastern kann sich unter Wärmezufuhr die Klebemassen verändern, was sich ungünstig auf die Klebeeigenschaften auswirken kann. Bei wirkstoffhaltigen Pflastern besteht zudem die Gefahr einer Veränderung der Freisetzungsrate: Durch Wärmeeinwirkung kann es dazu kommen, dass der Wirkstoff schneller als vorgesehen freigesetzt (dose dumping) und über die Haut aufgenommen wird. Folglich ist eine Überdosierung möglich. Bei opioidhaltigen Pflastern kann das sogar lebensbedrohlich sein. Ein weiteres Beispiel ist Acetylsalicylsäure: Die Substanz zersetzt sich bei Luftfeuchtigkeit und Wärme; es entsteht Essigsäure.
Damit ein Qualitätsverlust vermieden wird, müssen Medikamente bei bestimmten Temperaturen gelagert werden. Deshalb schreibt § 4 Abs. 2d Apothekenbetriebsordnung (ApBetrO) vor, dass in der Offizin „eine Lagerhaltung unterhalb einer Temperatur von 25 °C” möglich sein muss. Mit welchen technischen Mitteln das der Apotheker gewährleistet, bleibt ihm überlassen und ist nicht explizit genannt. In der Regel kommen Klimageräte zum Einsatz.
Doch warum bringen Hersteller nicht einfach thermostabile Wirkstoffe auf den Markt? Grundsätzlich ist die Thermostabilität eine Stoffeigenschaft. Arzneistoffe werden mal mehr, mal weniger von der Temperatur beeinflusst. Schon in der industriellen Produktion sind hitzeempfindliche Substanzen eine Herausforderung und auch aus der Rezeptur ist die Problematik bekannt. Hier können als Beispiele Metronidazol, Harnstoff und Salicylsäure genannt werden. Auch bei Erythromycin ist die Stabilität temperaturabhängig.
In der Regel findet sich auf jedem Arzneimittel beziehungsweise auf der Umverpackung oder der Gebrauchsinformation Hinweise zur Lagerung. Eine explizite Temperaturangabe ist dabei das Ergebnis von Stabilitätsprüfungen, die der Hersteller sowohl während der Entwicklungsphase, als auch im Zuge der Zulassung und sogar während der Vermarktung (On-going-Stabilitätsprüfungen) routinemäßig durchführen und dokumentieren muss. „Bei neuen Stabilitätsdaten kann beispielsweise das Verfallsdatum verlängert oder die Lagervorschriften angepasst werden“, verrät ein Mitarbeiter der pharmazeutischen Industrie.
Das Ziel von Stabilitätsprüfungen ist es, herauszufinden, wie sich das Arzneimittel oder der Wirkstoff unter Einfluss der Temperatur, Luftfeuchtigkeit sowie Licht während einer bestimmten Zeitperiode verändert. Dabei prüft der Hersteller, ob das Arzneimittel hinsichtlich der mikrobiologischen, physikalischen und chemischen Eigenschaften über den Lagerungszeitraum hinweg den festgelegten Spezifikationen entspricht. So darf beispielsweise der Gehalt des Arzneistoffes nicht unter 90 Prozent absinken, Zersetzungsprodukte dürfen nur minimal unterhalb bestimmter Grenzen auftreten. Außerdem darf die Freisetzung während der Lagerung nicht negativ beeinflusst werden.Temperatur und relative Luftfeuchtigkeit werden dabei abhängig von den durch die Klimazone vorgegebenen Anforderungen gewählt. Die genaue Durchführung der Haltbarkeitstest sind in den Richtlinien des International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) genau vorgeschrieben.
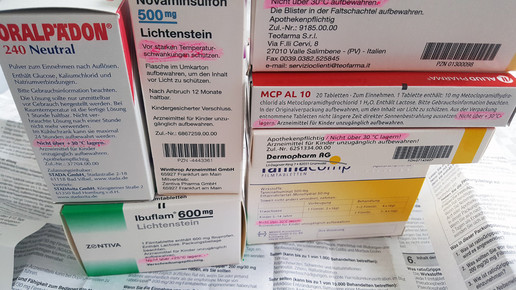
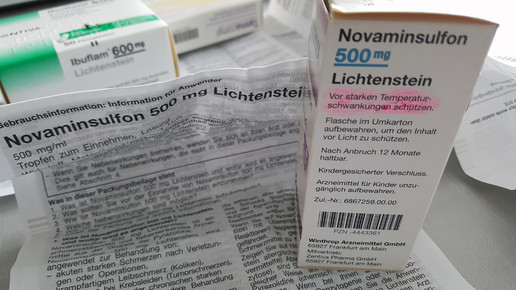
Die Aufschrift „Nicht über 25 Grad lagern” bedeutet übersetzt, dass der Hersteller „Long term“-Stabilitätsstudien durchgeführt hat, bei der das Arzneimittel bei 25 ± 2 Grad und 60 ± 5 Prozent Luftfeuchtigkeit getestet wurde. „Unter 30 Grad lagern“ hingegen bedeutet, dass eine Langzeitstudie bei 25 ± 2 Grad und 60 ± 5 Prozent relativer Luftfeuchtigkeit (RH; relative humidity) und zusätzlich entweder eine „Intermediate“-Stabilitätsstudie bei 30 ± 2 Grad und 60 ± 5 oder 65 ± 5 Prozent RH oder eine „Long term“-Stabilitätsstudie bei 30 ± 2 Grad und 65 ± 5 Prozent RH durchgeführt wurde. Wenn keine Angabe zur den Lagerbedingungen gemacht wird, beispielsweise bei Ratiogrippal (Ratiopharm), Ibu 400 1A Pharma, ACC Saft (Hexal) oder Antifungol Creme (Hexal), muss das Arzneimittel auch nicht zwangsweise bei 25 Grad gelagert werden. In der Gebrauchsinformation kann dann die Formulierung „Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich“ stehen. Hier wurde die Stabilität bei bei 25 ± 2 Grad, 60 Prozent RH (long term) und 40 ± 2 Grad, 75 Prozent RH (accelerated) oder 30 ± 2 Grad, 65 Prozent RH (long term) und 40 ± 2 Grad, 75 Prozent RH (accelerated) untersucht.
Allgemein sind kurzzeitige Temperaturschwankungen in Abhängigkeit vom Arzneistoff häufig möglich, ohne dass die Stabilität darunter leidet. Genauere Angaben zum jeweiligen Arzneimittel sind beim Hersteller zu erfragen.













































APOTHEKE ADHOC Debatte