Bundesregierung: Engpass bei Medizinprodukten möglich
Die Bundesregierung schließt Versorgungsengpässe bei Medizinprodukten nicht mehr aus und fordert eine rasche Korrektur der EU-Vorschriften. Die EU-Verordnung zur strengeren Kontrolle stelle die Hersteller vor große Probleme. Gesundheitsminister Jens Spahn (CDU) fordere gemeinsam mit 19 weiteren Staaten eine zeitnahe Lösung, etwa eine längere Übergangszeit für chirurgische Instrumente, heißt es in einer Antwort der Bundesregierung auf eine Anfrage der FDP-Bundestagsfraktion.
Viele Hersteller können ihre Produkte derzeit gar nicht prüfen lassen, weil die EU-Kommission alle Prüfstellen unter die Lupe nimmt. Bislang wurden aber nur der Tüv Süd in München und das BSI-Institut in Großbritannien als Prüfstellen zugelassen – zwei Institute für 25.000 Unternehmen mit 600.000 Beschäftigten und 100 Milliarden Euro Jahresumsatz. „Versorgungsengpässe können – Stand heute – nicht ausgeschlossen werden“, heißt es in der Antwort der Bundesregierung. Weil das britische Institut bei einem harten Brexit keine Bescheinigungen mehr ausstellen dürfte, könnte das „zu einer Verschärfung der ohnehin angespannten Situation“ führen. Es gebe „dringenden Handlungsbedarf auf europäischer Ebene“. Bis Jahresende soll die Zahl der Prüfstellen auf zehn steigen, bis Mai 2020 sollen es 20 sein. Selbst das scheint aber weit zu wenig, um einen reibungslosen Zertifizierungsprozess aller Produkte zu gewährleisten. Notwendig wären laut Bundesverband der Arzneimittelhersteller (BAH) mindestens 50.
Die Deutsche Krankenhausgesellschaft hat bereits gewarnt: „Wir laufen Gefahr, dass in Krankenhäusern bestimmte Medizinprodukte ab Mai fehlen werden.“ Die EU-Verordnung soll ab Mai 2020 greifen. Abweichende nationale Regelungen sind verboten. Die FDP-Gesundheitsexpertin Katrin Helling-Plahr sagte: „Das bedeutet Alarmstufe Rot für die Patienten.“ Es sei unverständlich, „wieso sich die Bundesregierung angesichts ihres Erkenntnisstandes über die Dimension des Problems so macht- und hilflos gibt“. Laue Appelle reichten nicht, die Regierung müsse auf EU-Ebene schnellstmöglich zum Handeln drängen.
Ab nächstem Jahr wird auf Grundlage einer EU-Verordnung aus dem Jahr 2017 schrittweise ein neues Kennzeichnungssystem für Medizinprodukte wie Nasensprays, Augentropfen und Lutschtabletten eingeführt. Die EU will mit der Verordnung aber auch den Herstellern von Herzschrittmachern, Skalpellen oder künstlichen Hüftgelenken genauer auf die Finger schauen. Hersteller haben bereits angekündigt, wegen der neuen Regelungen auch bewährte Produkte vom Markt zu nehmen, die Prüfer vom TÜV Süd sprechen von einem „Schlamassel“.
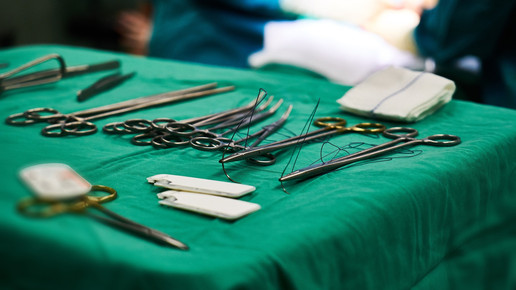
„Als Patient muss ich mir Sorgen machen, wenn ein Hersteller keine benannte Stelle findet oder Produkte aufgibt, weil der Aufwand zu groß wird und sich nicht mehr lohnt“, sagt TÜV-Süd-Experte Bassil Akra. Sorgen herrschen beispielsweise bei chirurgischen Scheren, für die jeder Hersteller ab kommendem Mai erstmals eine klinische Bewertung vorlegen muss. Sonst darf er keine mehr liefern. Einige Hersteller hätten ihre Produktpalette um ein Drittel verkleinert. Etablierte Produkte verschwänden vom Markt. Vor allem Implantate seien betroffen. „Ein Herzschrittmacher für Säuglinge zum Beispiel wird nur selten gebraucht, ist dann aber sehr wichtig“, erklärt Meinrad Kempf vom Branchenverband Medical Mountains im württembergischen Tuttlingen. Ein anderes Beispiel ist ein Netzhaut-Implantat für Menschen mit grauem Star: Ein Mittelständler, der es herstellt, gibt auf. Weil der Aufwand für Bestandsprodukte so steigt, bleiben weniger Zeit und Geld für neue Produkte. Gerade das aber sei die Stärke der deutschen Hersteller gewesen, sagt Kempf.





















APOTHEKE ADHOC Debatte