Ulipristal: Risiko wird geprüft
Ulipristalacetat wird neu bewertet: Die Europäische Arzneimittelagentur (EMA) hat ein Risikobewertungsverfahren für Esmya gestartet. Grund sind Meldungen schwerer Leberschädigungen.
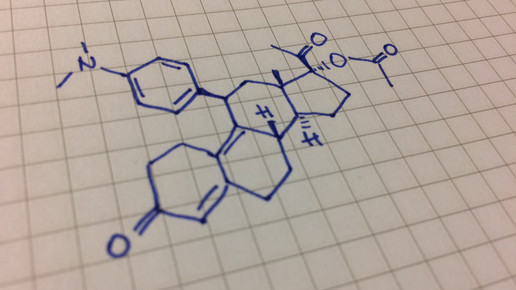
Esmya (Gedeon Richter) enthält 5 mg Wirkstoff und ist für die präoperative Behandlung von erwachsenen Frauen vor der Menopause mit mittleren bis starken Symptomen aufgrund von Uterus-Myeomen indiziert. Für die Betroffenen ist eine Operation vorgesehen. Ulipristal kommt zur Intervall-Therapie bei Frauen im gebärfähigen Alter zum Einsatz. Bei den Myomen handelt es sich um gutartige Tumore der Gebärmutter. Laut EMA wurden bislang 670.000 Frauen mit dem Progesteron-Rezeptormodulator behandelt.
Ausschlaggebend für das Risikobewertungsverfahren auf europäischer Ebene sind Berichte von schweren Leberschädigungen bei vier Patientinnen. In drei Fällen war eine Lebertransplantation nötig. Laut dem EMA-Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) besteht ein Zusammenhang zwischen den Leberschäden und Ulipristal. Die Experten werden nun festlegen, ob Anwendungsbeschränkungen erforderlich sind.
Einmalig anzuwendende Notfallkontrazeptiva wie EllaOne (HRA Pharma) sind von der Neubewertung und den Sicherheitsbedenken nicht betroffen. Für die „Pille danach“ liegen keine Berichte über schwere Leberschädigungen vor.
Esmya ist seit 2012 in der EU für die Behandlung der nicht-kanzerogenen Wucherungen der Gebärmutter bei Frauen bis zum Erreichen der Menopause zugelassen. Die orale Therapie kommt bis zu drei Monate lang vor der Operation und der Entfernung der Myome zum Einsatz. Patientinnen nehmen einmal täglich eine Tablette zu 5 mg zu einer Hauptmahlzeit oder zwischen den Mahlzeiten ein. Das erste Behandlungsintervall sollte während der ersten Menstruationswoche starten. Das folgende Intervall sollte frühestens während der ersten Woche der zweiten Menstruation nach dem abgeschlossenen ersten Therapiezeitraum beginnen. Die dreimonatige Behandlung kann mit Unterbrechungen zwischen jedem Behandlungszyklus wiederholt werden.
Ulipristal bindet als oral wirksamer, synthetischer und selektiver Progesteronrezeptormodulator an Rezeptoren auf Zellen, an die das Hormon normalerweise bindet, und verhindert damit den Effekt des Progesterons. Der Arzneistoff besitzt somit eine direkte Wirkung auf die Myome und reduziert deren Größe, da das Hormon das Myom-Wachstum fördern kann. Ulipristal hemmt die Zellteilung und löst zudem eine Apoptose aus. Häufige Nebenwirkungen während der Therapie können Amenorrhoe und eine Verdickung des Endometriums sein.
Als Notfallkontrazeptivum kann Ulipristal zu jedem Zeitpunkt des Menstruationszyklus eingenommen werden und ist seit 2015 rezeptfrei erhältlich. Nach ungeschütztem Geschlechtsverkehr oder Versagen der Kontrazeption sollte das Arzneimittel binnen 120 Stunden – entsprechend fünf Tagen – eingenommen werden. Kommt es innerhalb von drei Stunden nach dem Schlucken der Tablette zum Erbrechen, ist die Einnahme einer weiteren Tablette notwendig.




















APOTHEKE ADHOC Debatte