Plazomicin bei komplizierten Blasenentzündungen
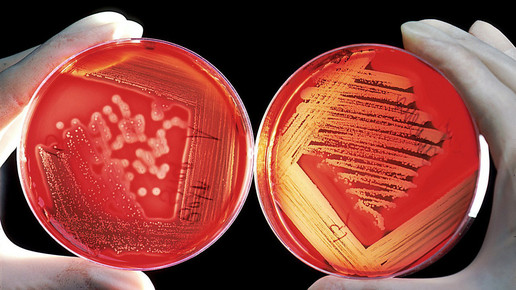
Neue Option bei komplizierter Blasenentzündung: In den USA ist Plazomicin bereits zugelassen. Für den europäischen Markt steht die Entscheidung noch aus. Zemdri (Achaogen) könnte auch hierzulande eine neues Antibiotikum gegen resistente Bakterien werden. Eine aktuelle Studie zeigt, dass der Arzneistoff Meropenem nicht unterlegen ist.
Zemdri hat von der US-Arzneimittelbehörde FDA die Zulassung zur Behandlung komplizierter Harnwegsinfektionen einschließlich Pyelonephritis erhalten. Voraussetzung ist, die Infektion ist durch Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis oder Enterobacter cloacae verursacht. Allerdings ist das Arzneimittel nicht Mittel der ersten Wahl, sondern sollte nur bei Patienten angewendet werden, für die begrenzte oder keine alternativen Behandlungsoptionen zur Verfügung stehen. Der Grund: Für Zemdri standen zum Zeitpunkt der Zulassung nur begrenzte Daten zu Sicherheit und Wirksamkeit zur Verfügung.
Die Behörde kam zu dem Schluss: Plazomicin sollte zur Reduktion der Entwicklung von Resistenzen nur dann eingesetzt werden, wenn die Infektion nachweislich von resistenten gramnegativen Bakterien inklusive Carbapenem-resistenten Enterobakterien und MRSA verursacht wurde. Ausgangssubstanz des Wirkstoffes ist das Aminoglykosid Sisomicin. Das Anhängen von zwei Seitenketten macht den Wirkstoff unempfindlich gegen jene bakteriellen Enzyme, die den Bakterienresistenzen zugrunde liegen.
Die Gebrauchsinformation von Zemdri enthält eine Black-Box-Warnung (Boxed Warning), das auf unerwünschte Wirkungen wie Nephro- und Ototoxizität sowie neuromuskuläre Blockaden und Embryotoxizität hinweist. Das Arzneimittel wird als Infusion verabreicht. Die Patienten mit einer Kreatinin-Clearance von 90 ml/ min oder mehr erhalten alle 24 Stunden 15 mg/kg KG über einen Zeitraum von 30 Minuten. Die empfohlene Behandlungsdauer bei komplizierten Harnwegsinfektionen beträgt vier bis sieben Tage. Vor und während der Behandlung ist die Kreatinin-Clearance der Betroffenen zu überwachen.
Eine im „New England Journal of Medicine“ veröffentlichte Studie zeigt die Wirksamkeit von Plazomicin im Vergleich zu Meropenem. Das Carbapenem besitzt bakterizide Eigenschaften und hemmt bei grampositiven und gramnegativen Bakterien durch Bindung an Penicillin-bindende Proteine die Zellwandsynthese. 609 Patienten mit kompliziertem Harnwegsinfekt einschließlich Pyelonephritis wurden im Verhältnis 1:1 randomisiert. Die Studienteilnehmer wurden entweder mit Plazomicin i.v. zu 15 mg/kg KG einmal täglich oder Meropenem zu 1 g alle acht Stunden behandelt. Als klinische Endpunkte wurden die klinische Heilung und die mikrobiologische Eradikation an Tag 5 der Behandlung festgelegt. Die Unterlegenheit von Plazomicin durfte in Bezug auf den primären Endpunkt nicht mehr als 15 Prozent betragen.
In der Auswertung der primären Wirksamkeitsendpunkte zeigte sich Plazomicin Meropenem nicht unterlegen. An Tag 5 wurde bei 88 Prozent der Probanden der primäre Endpunkt erreicht, unter Meropenem waren es 91,4 Prozent. Bei einer Differenz von 3,4 Prozent und einem Konfidenzintervall von 95 Prozent wurde die zulässige Abweichung von 15 Prozent nicht überschritten. Auch in Bezug auf die Heilung war Plazomicin nicht unterlegen; 81,7 Prozent zu 70,1 Prozent. Hier war der neue Wirkstoff signifikant besser.
Achagon hat bei der Europäischen Arzneimittelbehörde (EMA) im Oktober einen Zulassungsantrag für die Behandlung komplizierter Harnwegsinfekte, inklusive Pyelonephritis, Blutstrom und anderer Indikationen aufgrund von Enterobacteriaceae gestellt. Das Breitbandantibiotikum zählt zur Klasse der Aminoglykoside.















APOTHEKE ADHOC Debatte