Entresto: Diovan 2.0
Novartis hat in den USA die Zulassung für sein Herzmedikament Entresto (Sacubitril/Valsartan) erhalten. Der Konzern hofft auf einen neuen Blockbuster in der Behandlung von Herzinsuffizienz: Weltweit könnte das Mittel Umsätze von bis zu fünf Milliarden US-Dollar in die Kasse spülen – alleine in der Erstindikation, der Behandlung der Herzinsuffizienz mit reduzierter Ejektionsfraktion (HF-REF).
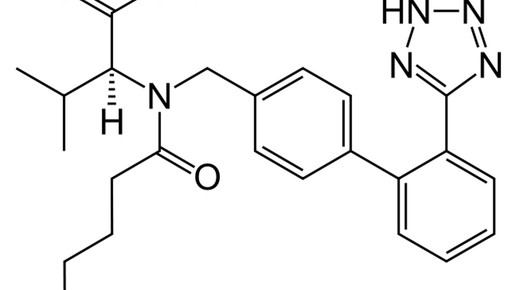
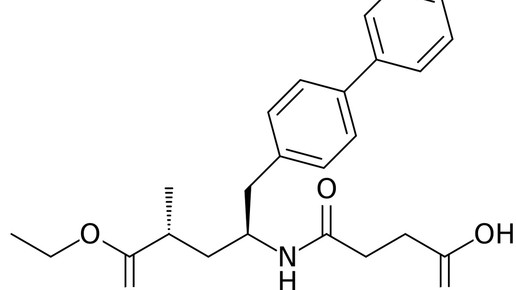
Entresto wird zweimal täglich in Tablettenform eingenommen und enthält den Angiotensin-Antagonisten Valsartan, den Novartis als Altoriginal unter dem Namen Diovan vermarktet, und Sacubitril, einen Neprilysin-Hemmer. Das Enzym, das auch als neutrale Endopeptidase (NEP) bekannt ist, baut in der Niere unter anderem natriuretische Peptide ab; dadurch steigt die Volumenbelastung für das Herz.
Im März 2014 hatte Novartis eine Studie vorzeitig beendet, nachdem der primäre Endpunkt bereits erreicht worden war. An der randomisierten, doppelblinden Phase-III-Studie nahmen knapp 8500 Männer und Frauen im Alter von durchschnittlich 64 Jahren teil, die an HF-REF litten. Bezüglich Mortalität und Krankenhauseinweisungen war die Kombination dem Vergleichspräparat Enalapril deutlich überlegen.
Während der Studie verstarben in der Vergleichsgruppe 20 Prozent, in der Verumgruppe waren es 17 Prozent. Demnach reduzierte das Prüfpräparat das kardiovaskulär bedingte Sterberisiko um 20 Prozent. Zudem verringerte Entresto, das damals noch unter dem Prüfnamen LCZ696 firmierte, die Krankenhausaufenthalte aufgrund von Herzinsuffizienz um 21 Prozent und das Gesamtmortalitätsrisiko um 16 Prozent. Insgesamt zeigte sich eine Risikosenkung von 20 Prozent – ein kombinierter Wert, der sich aus kardiovaskulär bedingten Todesfällen und Krankenhausaufenthalten wegen Herzinsuffizienz zusammensetzt.
Zudem setzten Patienten, die LCZ696 erhielten, die Studienmedikation seltener wegen Nebenwirkungen ab als Patienten, die Enalapril erhielten (10,7 und 12,3 Prozent). Die LCZ696-Gruppe litt stärker an Hypotonie und nicht schwerwiegenden Angioödemen, aber weniger an Nierenfunktionsstörungen, Hyperkaliämie und Husten als die Enalapril-Gruppe. Insgesamt waren die Risikoprofile vergleichbar.
Erster Vertreter der Substanzklasse war vor 15 Jahren Omapatrilat, das eine zusätzliche Wirkung als ACE-Hemmer aufwies. Bristol-Myers Squibb musste die klinische Entwicklung jedoch stoppen, weil vermehrt lebensgefährliche Angioödeme aufgetreten waren. Ursache war vermutlich die Blockade verschiedener Bradykinin-abbauender Enzyme. Durch die Kombination von Sacubitril mit Valsartan soll diese Nebenwirkung verhindert werden.
Novartis hat bereits Zulassungsanträge weltweit eingereicht, auch in Europa läuft das Verfahren. Alleine in den USA kommen laut Konzern sechs Millionen Patienten in der Erstindikation für die Behandlung in Frage. Diovan war bis zum Patentablauf im Jahr 2011 das wichtigste Mittel von Novartis; Valsartan und die Kombination mit HCT wird zur Behandlung der Hypertonie eingesetzt.



















APOTHEKE ADHOC Debatte