Berlin -
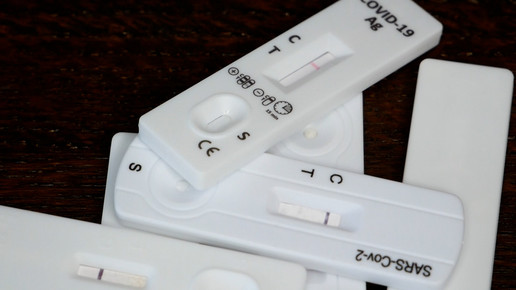
Das Warten hat ein Ende. Eine Woche früher als gedacht erhalten die ersten Schnelltests die Sonderzulassung vom Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM). Drei In-vitro-Diagnostika dürfen nun an den Endverbraucher abgegeben werden. Darunter auch der Clinitest von Siemens Healthcare.
Eigentlich hatte das BfArM mit Anfang März kalkuliert, nun kann der Verkauf rund eine Woche früher als gedacht starten. Insgesamt erhielten drei Antigen-Schnelltests die Sonderzulassung. Neben dem Clinitest von Siemens Healthcare haben zwei chinesische Tests das „Go“ erhalten. Im Einzelnen handelt es sich um folgende Produkte:
Clinitest Rapid Covid-19 Self-Test
- Hersteller: Healgen Scientific LLC, Houston, USA
- Antragsteller: Siemens Healthcare Diagnostics Products GmbH, Marburg
- Sensitivität: 97,25 Prozent; Spezifität: 100 Prozent
- Nasenabstrich aus dem vorderen Bereich
Rapid Sars-CoV-2 Antigen Test Card
- Hersteller: Xiamen Boson Biotech Co., Ltd, Xiamen, China
- Antragsteller: Technomed Service GmbH, Graz, Österreich
- Sensitivität: 96,49 Prozent; Spezifität: 99,03 Prozent
- Nasenabstrich aus dem vorderen Bereich
Lyher Covid-19 Antigen Schnelltest (Nasal)
- Hersteller: Hangzhou Laihe Biotech Ltd. Co., Hangzhou, China
- Antragsteller: Lissner Qi GmbH, Hamburg
- Sensitivität: 96,16 Prozent; Spezifität: 99,70 Prozent
- Nasenabstrich aus dem vorderen Bereich
Newsletter
Das Wichtigste des Tages direkt in Ihr Postfach. Kostenlos!
Lesen Sie auch
Neuere Artikel zum Thema
Mehr zum Thema
adhoc24 vom 26.7.24
Noch 17.290 Apotheken / Apotheken zahlen für Notfallreform / L’Oréal-Selektivvertrag / PKV-E-Rezepte
Nicht via Gedisa
CardLink vor Ort: Gesund.de startet zum 31. Juli
Wegen schwerer Nebenwirkungen
EMA lehnt Alzheimer-Wirkstoff ab
Mehr aus Ressort
„Pandemie der Ungeimpften“
RKI-Protokolle bringen Spahn unter Druck
Virusvariante JN.1
Ab August: Neuer Covid-Impfstoff verfügbar
Corona-Protokolle
Lauterbach: „Es gibt nichts zu verbergen“























APOTHEKE ADHOC Debatte