Zulassung für Sarilumab
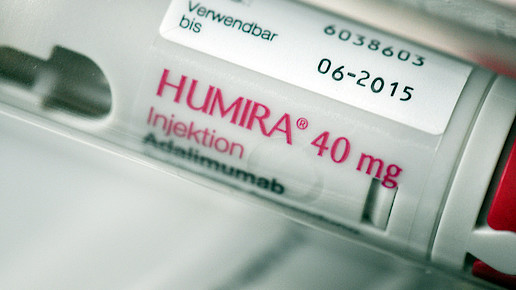
Im Mai hatte Kevzara (Sarilumab, Sanofi) von der Europäischen Arzneimittelagentur (EMA) die Zulassungsempfehlung erhalten. Zum 23. Juni erfolgte dann die Zulassung durch die Europäische Kommission. Nun steht Kevzara als Therapieoption der rheumatoiden Arthritis (RA) zur Verfügung. In Europa sind etwa drei Millionen Menschen von der Erkrankung betroffen. In Studien zeigte sich das Arzneimittel als Monotherapie gegenüber dem Blockbuster Humira (Adalimumab, Abbvie) überlegen.
Kevzara ist als Fertigspritze und Pen zur subkutanen Injektion auf dem Markt. Zur Verfügung stehen die Stärken 150 und 200 mg. Die empfohlene Dosis liegt bei 200 mg alle zwei Wochen. Während der Behandlung können Nebenwirkungen wie Infektionen der oberen Atemwege, Erythem an der Injektionsstelle oder Harnwegsinfekte auftreten. Im Falle einer durch die Behandlung ausgelösten Neutropenie, Thrombozytopenie oder Erhöhung der Leberenzymwerte wird eine Dosisreduktion auf 150 mg alle zwei Wochen empfohlen.
Das Arzneimittel ist in Kombination mit Methotrexat (MTX) zur Behandlung der mittelschweren bis schweren aktiven RA bei Erwachsenen, die auf eine oder mehrere krankheitsmodifizierende Antirheumatika nur unzureichend angesprochen oder diese nicht vertragen haben, zugelassen. Sarilumab kann jedoch auch als Monotherapie verabreicht werden, wenn der Patient MTX nicht verträgt oder dies nicht angezeigt ist.
Der humane, monoklonale Antikörper richtet sich selektiv gegen den Interleukin (IL)-6-Rezeptor und hemmt die IL-6 vermittelte Signalweiterleitung – die proinflammatorische Signalkaskade wird unterbrochen. Anzeichen und Symptome der rheumatoiden Arthritis können reduziert werden. Das Arzneimittel verhindert somit das Fortschreiten von Gelenkschäden. In den Gelenken der RA-Patienten kann IL-6 in einer bis zu 1000-fach erhöhten Konzentration vorliegen. IL-6 stimuliert verschiedene Zellreaktionen wie Proliferation, Differenzierung, Überleben und Apoptose. Außerdem ist IL-6 an unterschiedlichen physiologischen Prozessen wie Aktivierung von T- und B-Zellen, Monozyten und Osteoklasten beteiligt. Diese können bei Patienten mit RA zu systemischen Entzündungen oder Knochenerosionen führen.
Die Wirkung von Kevzara konnte in mehreren Studien belegt werden. Die im Rahmen des globalen klinischen Saril-Ra-Entwicklungsprogrammes ermittelten Daten beziehen sich auf mehr als 3300 erwachsene Probanden mit mittelschwerer bis schwerer RA. In einigen Studien wurde nicht nur die Wirkung im Vergleich zu Placebo sondern auch im Vergleich zu Humira (Adalimumab, AbbVie) durchgeführt.
Die Saril-Ra-Monarch-Studie verglich den Nutzen der Monotherapie unter Sarilumab 200 mg mit der Adalimumab-Behandlung. Kevzara zeigte sich im Erreichen der primären Endpunkte überlegen: etwa 43 Prozent der Probanden zeigten in 24 Wochen einen Status geringer Krankheitsktivität, etwa 27 Prozent erreichten eine Remission. Unter Adalimumab waren es im Vergleich etwa 14 Prozent beziehungsweise 7 Prozent. Die Verträglichkeit der Therapieregime war vergleichbar.
Humira ist der Blockbuster bei AbbVie. Im Jahr 2015 hatte der rekombinante humane monoklonale Antikörper etwa 12,5 Milliarden Euro eingebracht – mehr als 60 Prozent des Gesamtumsatzes. Die Lagerung des Arzneimittels muss im Kühlschrank erfolgen. Kevzara kann bis zu zwei Wochen vor der Verwendung bei Raumtemperatur, jedoch nicht über 25 Grad aufbewahrt werden.


































APOTHEKE ADHOC Debatte