Virusprotein gegen Krebs
Die Entwicklung von Wirkstoffen für die Krebstherapie ist eine Herausforderung. Angegriffen werden sollen möglichst spezifisch Strukturen, gesunde Zellen sollen verschont werden. Forscher der Technischen Universität München haben jetzt ein solches Molekül entwickelt: Das Peptid, ein Integrin-Inhibitor, geht auf ein Protein zurück, welches im Erreger der Maul- und Klauenseuche vorkommt. Durch die hohe Selektivität an Krebszellen könnte die Behandlung mit der Substanz besonders nebenwirkungsarm sein.
Integrine sind essentielle Proteine, die stark in die Kommunikation der Zelle mit ihrer Außenwelt eingebunden sind und ihr dabei helfen, sich den umliegenden Gegebenheiten anzupassen. Sie sitzen auf der Zelloberfläche und sind damit eine wichtige Verbindung zu anderen Zellen. Integrine interagieren in der extrazellulären Matrix mit Proteinen anderer Zellen, halten sie im Verbund und transportieren äußere Signale ins Zellinnere. Dafür können beispielsweise Signalkaskaden initiiert werden, die eine Zellteilung oder -migration anstoßen.
Auch Krebszellen nutzen Integrine für die Steuerung der Multiplikation und Migration. Integrin-gesteuerte Signalkaskaden sind beispielsweise für die Ablösung von Krebszellen aus dem Primärtumor verantwortlich. So gelangen sie in die Blutbahn und bilden in anderen Geweben Metastasen.
Welche der über 20 Integrin-Subtypen spezifische Vorgänge in der Zelle steuern, ist sehr unterschiedlich. Dies macht auch die Suche nach geeigneten Inhibitoren für die Krebstherapie für Forscher sehr schwierig: Ein Produkt, das einen Protein-Typ effektiv blockiert, kann für einen anderen unwirksam sein. Außerdem muss ein potenzieller Arzneistoff so beschaffen sein, dass er möglichst spezifisch an tumoreigene Integrine bindet und die Subtypen von gesunden Zellen verschont.
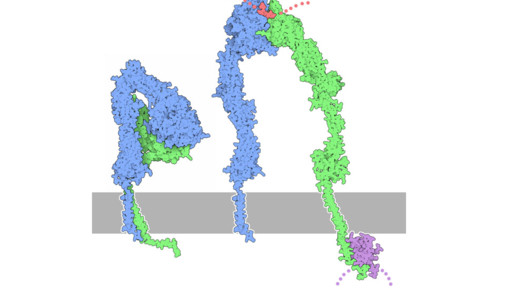
Die Münchener Forschergruppe um Professor Dr. Horst Kessler hat nun einen solchen Liganden entwickelt. Die Wissenschaftler haben ein ringförmiges Minipeptid gebaut, welches hochspezifisch an das Integrin mit Namen alphaVbeta6 bindet. Der Subtyp wurde bislang vor allem in Tumorzellen gefunden – dort wird er stark überexprimiert.
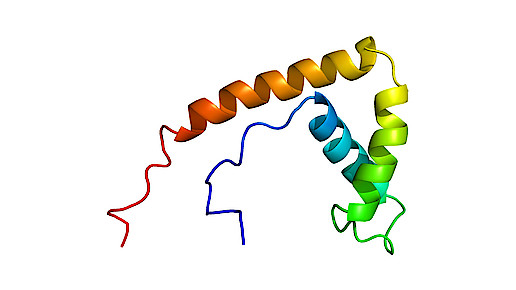
Als Vorlage für das Molekül diente ein Protein des Erregers der Maul-und-Klauenseuche. Über dieses verschafft sich das Virus Eintritt in die menschliche Zelle. Das MKS-Protein besitzt eine helikale Struktur, mit der es an das Integrin bindet. Diese Struktur imitierten die Forscher zunächst. Anschließend wurde nach dem Prinzip des „Rational Drug Design“ die Struktur immer weiter verkleinert und auf die essentiellen Strukturkomponenten reduziert.
Aus einer Vielzahl verschiedener Prototypen konnte eine Variante gefunden werden, deren Affinität an alphaVbeta6 extrem spezifisch ist – eine Voraussetzung für eine nebenwirkungsarme Behandlung. Weiterhin konnte eine Inhibierung des Integrins bereits in niedrigen Konzentrationen erreicht werden. Aufgrund der zyklischen Struktur ist das Molekül außerdem stabil gegenüber metabolischen Enzymen und wird dementsprechend nur langsam abgebaut – dies weist auf eine lange Wirksamkeit des Wirkstoffes hin.
Nicht nur für die onkologische Therapie könnte der neue Wirkstoff interessant sein. Eine besondere Eigenschaft macht die Substanz auch zu einem geeigneten Kandidaten für die Diagnostik: Eine der sieben Aminosäuren, Lysin, eignet sich nach Ansicht der Forscher für eine Kopplung von anderen Substanzen, die beispielsweise in bildgebenden Verfahren sichtbar gemacht werden können. Auf diese Weise erhoffen sich die Wissenschaftler eine Möglichkeit, den Tumor genauer charakterisieren und eine individualisierte Therapie besser planen zu können.














APOTHEKE ADHOC Debatte