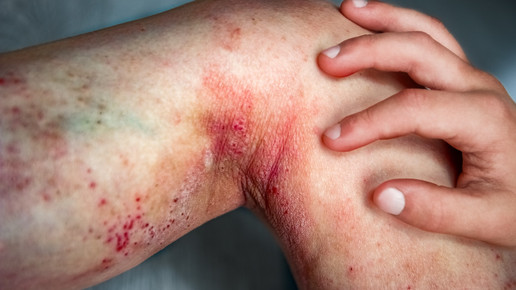
Lebrikizumab für Atopische Dermatitis zugelassen
Die Europäische Kommission hat Ebglyss (Lebrikizumab) zur Behandlung von moderater bis schwerer Atopischer Dermatitis (AD) zugelassen. Deutschland ist das erste Land, in dem das verschreibungspflichtige Präparat erhältlich sein wird. Ebglyss richtet sich an Patient:innen, die auf topische Behandlungen nicht ausreichend ansprechen.
Ebglyss ist für Patient:innen ab zwölf Jahren und mindestens 40 Kilogramm Körpergewicht zugelassen und wird zunächst in Deutschland vermarktet. Almirall hat die Lizenzen für die Entwicklung und Vermarktung von Lebrikizumab in Europa für dermatologische Anwendungen wie atopische Dermatitis. Eli Lilly besitzt die Rechte außerhalb Europas. Almirall plant die Einführung in weiteren europäischen Ländern wie England und der Schweiz für 2024.
Die Zulassung basiert auf drei Phase-III-Studien. In zwei dieser Studien wurde der Wirkstoff als Monotherapie untersucht. In der dritten Studie wurde Lebrikizumab in Kombination mit topischen Kortikosteroiden getestet.
Wirkungsmechanismus
Ebglyss enthält den monoklonalen Antikörper Lebrikizumab. Dieser Antikörper blockiert gezielt das Zytokin Interleukin 13 (IL-13). Ein ähnliches Präparat, Tralokinumab, ist bereits zugelassen und wirkt auch gegen IL-13. Im Unterschied zu Dupilumab richtet sich Lebrikizumab jedoch ausschließlich gegen IL-13. Dupilumab hingegen zielt auf IL-4 und IL-13 ab. IL-13 hat eine zentrale Bedeutung bei der Entwicklung der atopischen Dermatitis. Es fördert insbesondere entzündliche Vorgänge in der Haut.
Anwendung und Nebenwirkungen
Die Verabreichung von Ebglyss erfolgt durch eine subkutane Injektion. Zu Beginn der Behandlung erhalten Patienten alle zwei Wochen eine Injektion. Verbessert sich die Erkrankung unter der Therapie, wird die Injektion auf eine monatliche Erhaltungsdosis reduziert. Sowohl in der Monotherapie als auch in Kombination mit topischen Kortikosteroiden zeigte das Präparat eine frühe klinische Wirksamkeit. Bei sechs von zehn Patient:innen konnte das Ausmaß und die Schwere der AD um mindestens 75 Prozent reduziert werden. In der Kombinationstherapie konnten sieben von zehn Betroffenen erfolgreich behandelt werden: Nach 16 Wochen waren circa 80 Prozent der AD-Symptome zurückgegangen.
Die häufigste beobachtete Nebenwirkung ist eine Reaktion an der Injektionsstelle. Darüber hinaus kann sich ein trockenes Auge bis hin zu Konjunktivitis einstellen. Die Nebenwirkungen werden insgesamt als mild bis moderat bewertet und waren insgesamt gut zu behandeln.


















APOTHEKE ADHOC Debatte