Remdesivir für 30.000 Europäer
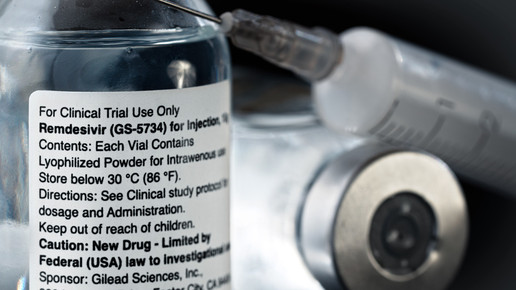
Remdesivir war am 3. Juli zur Behandlung von Covid-19-Patienten ab 12 Jahren zugelassen worden, die an einer Lungenentzündung erkranken und zusätzlich Sauerstoff benötigen. Kurz vorher hatte die US-Regierung eine Vereinbarung mit Gilead Sciences bekannt gemacht, wonach sie praktisch die gesamte Produktionsmenge des Mittels für die nächsten Monate aufgekauft habe. Nun hat auch die EU-Kommission einen Bezugsvertrag mit dem Hersteller Gilead geschlossen.
Zur Versorgung von 30.000 schwerkranken Covid-Patienten mit dem Mittel Remdesivir hat die EU-Kommission einen Bezugsvertrag mit dem Hersteller Gilead geschlossen. Der Wirkstoff – die bisher einzige in Europa zugelassene Arznei gegen schwere Fälle von Covid-19 – werde ab Anfang August ausgeliefert, teilte die Brüsseler Behörde am Mittwoch mit. Die Menge reiche für den dringenden Bedarf in der EU und Großbritannien und werde gerecht verteilt. Die EU-Kommission zeigt sich aber sicher, mit dem jetzt geschlossenen Vertrag „den derzeitigen Bedarf in den kommenden Monaten zu decken“. Die Kosten bezifferte die EU-Kommission auf 63 Millionen Euro. Sie werden aus EU-Mitteln gedeckt. Man verhandele darüber hinaus über die gemeinsame Beschaffung der Arznei zur Deckung des zusätzlichen Bedarfs, mit dem ab Oktober zu rechnen sei, hieß es weiter.
Ärzte sehen Remdesivir – der Markenname ist Veklury – nicht als Allheilmittel, wohl aber als Lichtblick für Corona-Patienten. Eine internationale Studie mit mehr als 1000 Teilnehmern hatte Ende April gezeigt, dass Remdesivir bei Covid-19-Patienten die Zeit bis zu einer Genesung im Schnitt um vier Tage verkürzen kann – von 15 auf 11 Tage. Remdesivir wurde ursprünglich zur Behandlung von Ebola entwickelt, zeigte aber eine zu geringe Wirkung.
Gilead will den Einsatz auch für Kinder und Schwangere ermöglichen und plant Studien innerhalb dieser Patientengruppen. „Wir arbeiten daran, unser Verständnis für den vollen Nutzen von Remdesivir zu erweitern. Um der Dringlichkeit der anhaltenden Pandemie zu begegnen, teilen wir so schnell wie möglich Daten mit der Forschungsgemeinschaft, um transparente und zeitnahe Aktualisierungen neuer Entwicklungen mit Remdesivir bereitzustellen“, sagte Dr. Merdad Parsey, Chief Medical Officer bei Gilead. Aus Analysen des Compassionate-Use-Programms konnte bisher gezeigt werden, dass 83 Prozent der pädiatrischen Patienten (n = 77) und 92 Prozent der schwangeren Frauen (n = 86) bis zum 28. Tag wieder gesund wurden. In diesen Populationen wurden keine neuen Nebenwirkungen mit Remdesivir identifiziert.



















APOTHEKE ADHOC Debatte