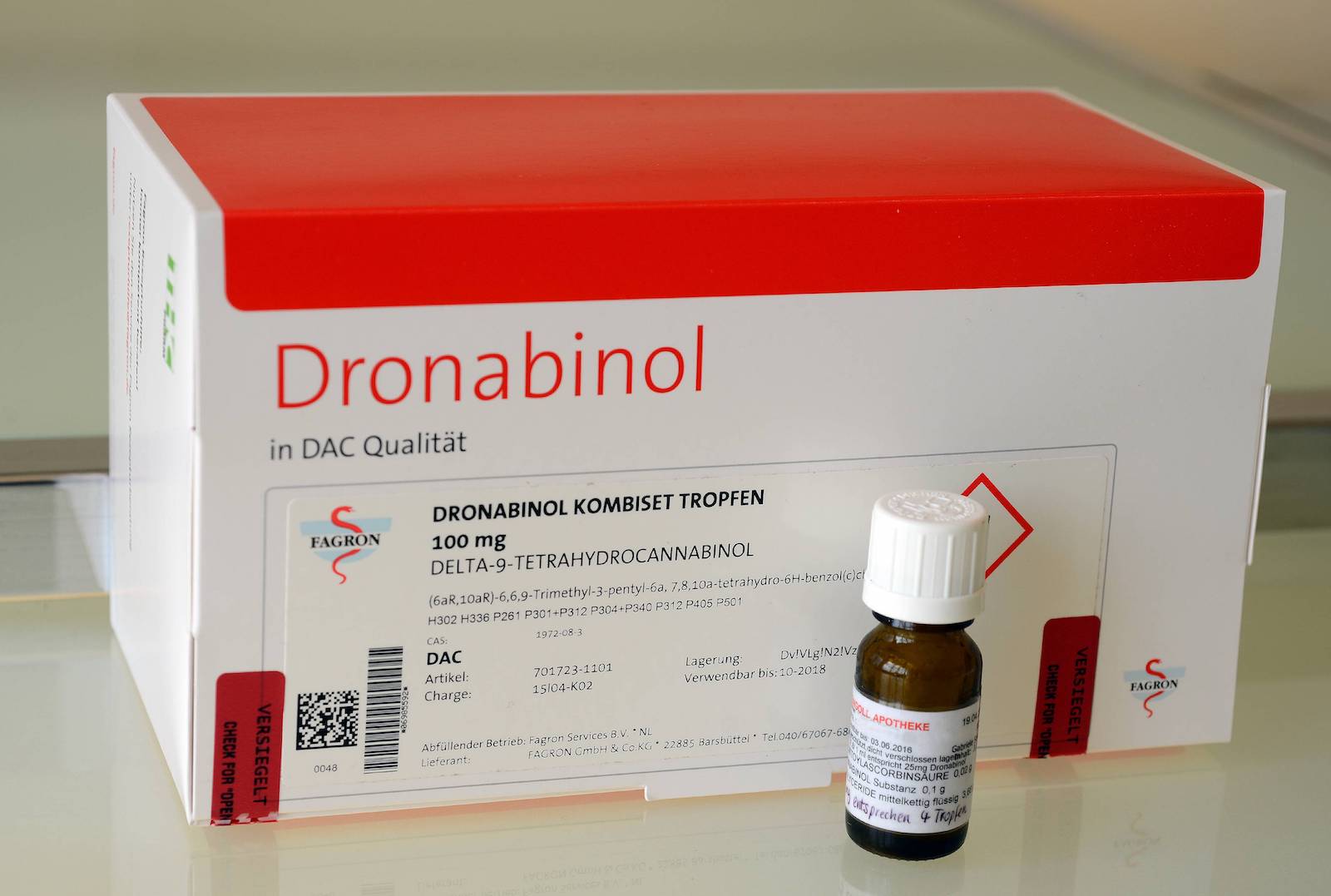
Caelo hält Dronabinol-Urteil für unzutreffend
Die Dronabinol-Lösung von Caelo wurde laut einem Urteil des Verwaltungsgerichts Düsseldorf (VG) als Fertigarzneimittel (FAM) eingestuft. Das Urteil scheint paradox, denn die Arzneimittelbehörde eines anderen Bundeslandes stufte ein exakt gleiches Produkt eines anderen Anbieters ausdrücklich nicht als FAM, sondern als Rezepturarzneimittel ein. Erst auf diese Einstufung hin hatte Caelo sein Produkt auf den Markt gebracht. „Inhaltlich halten wir die Begründung des Urteils für unzutreffend, weil sie auf einem verengten Prüfungsmaßstab beruht“, so der Hersteller.
Für die Richter war klar: Die Arbeitsschritte, die in der Apotheke hinzukommen, damit Dronabinol noch als Rezepturarzneimittel abgegeben werden kann, reichen nicht aus. Konkret: Obwohl die Dronabinol-Lösung geprüft, umgefüllt sowie beschriftet werden muss, wurde das Set von Caelo als Fertigarzneimittel eingestuft und das Inverkehrbringen damit untersagt.
Caelo ist verwundert: „Die Untersagung erfolgte im Widerspruch zu einer uns vorliegenden schriftlichen Stellungnahme der Arzneimittelbehörde eines anderen Bundeslandes, welche ein exakt gleiches Produkt eines anderen Anbieters (das sich weiterhin im Markt befindet) ausdrücklich nicht als Fertigarzneimittel eingestuft hat. Auf diese Einstufung hin hatten wir unser Produkt auf den Markt gebracht.“ Deswegen halte man die Begründung des Urteils inhaltlich für unzutreffend. „Weil sie auf einem verengten Prüfungsmaßstab beruht.“
Voraussetzung für ein FAM sei, „dass es zur Abgabe an Verbraucher bestimmt ist“, so das Unternehmen. „Das ist nach dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) nur dann der Fall, wenn es ohne einen weiteren Herstellungsschritt in der Apotheke an Verbraucher abgegeben werden kann, d. h. ohne Tätigkeit der Apotheke schon aus sich heraus gebrauchsfertig ist.“ Dafür müsse sich das Arzneimittel in einem zur unmittelbaren Abgabe an Verbraucher geeigneten Behältnis befinden, weil die Patientinnen und Patienten das Arzneimittel sonst nicht anwenden könnten.
„Unsere Dronabinol-Lösung ist nicht verbrauchsfertig; sie kann bei korrekter Handhabung in der Apotheke nicht ohne weitere Herstellungsschritte in der Apotheke an Patientinnen und Patienten abgegeben werden“, erklärt Caelo. Hinzu komme, dass das Verwaltungsgericht Düsseldorf eine Veränderung der Substanz des Arzneimittels in der Apotheke für erforderlich halte, damit das Arzneimittel ein Rezepturarzneimittel sei. „Vom Erfordernis einer Substanzveränderung ist aber in den gesetzlichen Vorgaben nirgendwo die Rede“, macht der Hersteller deutlich. „Auch haben wir das Produkt in jeglicher Darstellung ausschließlich als Rezepturhilfe für die Apotheken und als nicht für die Abgabe an Verbraucher geeignet beworben.“
Man sei überzeugt, dass dem Sinn der Zulassungspflicht von Fertigarzneimitteln – der Arzneimittelsicherheit – mit diesem Urteil nicht Rechnung getragen werde. „Der einzige Effekt der Einordnung unseres Produkts als Fertigarzneimittel ist, dass nun bei einer vorliegenden ärztlichen Verordnung ein – von der zuständigen Behörde nicht als Fertigarzneimittel angesehenes – baugleiches Wettbewerbsprodukt eingesetzt wird, oder die Apotheke die Substanz mit dem Föhn selbst löst, oder dass ein industriell vorgefertigtes Konzentrat verdünnt wird“, so Caelo.
„Einen positiven Effekt auf die Arzneimittelsicherheit können wir in keinem dieser Fälle erkennen. Es ist gerade umgekehrt: Unser Produkt verbessert durch den Wegfall einiger nach der herkömmlichen Rezeptur vorgesehener risikoanfälliger Herstellungsschritte wie des Föhnens in der Apotheke die Arzneimittelsicherheit“, erläutert der Hersteller.
Mehr noch: „Im Übrigen wäre der gesamte Markt der Cannabis-Blüten und -extrakte bei der diesem Urteil zugrundeliegenden Sichtweise nicht mehr zu bedienen, weil bei der rezepturmäßigen Abgabe in aller Regel ebenfalls keine materielle Veränderung der Substanz stattfindet“, gibt Caelo zu bedenken. „Das gleiche gilt für alle in unveränderter Form als Tee abgepackten und abgegebenen Heilkräuter, für die daraus gewonnenen Tinkturen und Extrakte und für eine Reihe anderer typischer und therapierelevanter Rezeptursubstanzen.“ So wären diese nach dem Maßstab des Verwaltungsgerichts Düsseldorf zulassungspflichtige Fertigarzneimittel.
„Und warum sollte die Arzneimittel-Preisverordnung – abweichend von den Vorgaben für Fertigarzneimittel in § 3 – in ihrem § 4 eine Vorgabe machen, welche Aufschläge die Apotheke für in unverändertem Zustand abgegebene Stoffe zu erheben hat, wenn eine solche Abgabe von Stoffen in unverändertem Zustand mangels Substanzveränderung rechtswidrig wäre“, so Caelo. Nachdem die Klage vom Gericht abgewiesen wurde, legte Caelo bereits Rechtsmittel ein.
lesen Sie weiter.