Krebsmittel aus Bodenbakterien
Bisher ist bekannt, dass der Naturstoff Carolacton ein hochpotenter Biofilm-Inhibitor ist und antibiotische Eigenschaften hat. Wissenschaftler am Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS) und am Helmholtz-Zentrum für Infektionsforschung (HZI) fanden jetzt heraus, dass der bakterielle Wirkstoff ein Schlüsselenzym des Folsäurestoffwechsels hemmt und daher künftig als Krebsmedikament eingesetzt werden könnte. Ihre neuen Erkenntnisse veröffentlichten sie im Fachjournal „Nature Communications“.
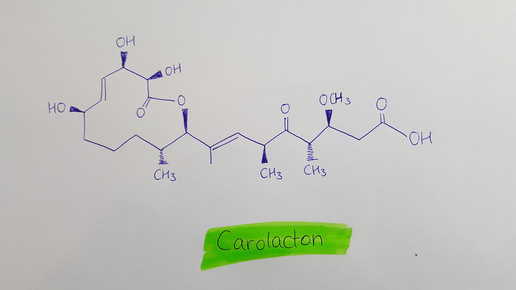
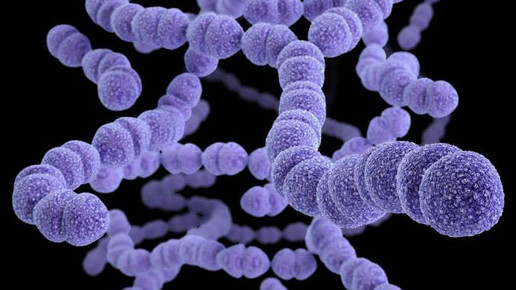
Carolacton ist ein Sekundärmetabolit aus dem Myxobakterium Sorangium cellulosum und gehört zur Klasse der Polyketide. Warum die Substanz antibiotisch wirkt, ist noch unbekannt. „Carolacton kann wichtige Prozesse in Bakterien stören“, sagt Professor Dr. Rolf Müller, Leiter der Abteilung „Mikrobielle Naturstoffe“ und Geschäftsführender Direktor am Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS). „Gleichzeitig ist Carolacton ein Wachstumsinhibitor von Streptococcus pneumonieae, einem der lebensbedrohlichsten Mikroorganismen.“
Weiterhin greift die Substanz auch in die Biofilmbildung von grampositiven Bakterien ein, die durch Anheftung von Mikroorganismen vorzugsweise an wässrigen Grenzflächen entstehen. Die Erreger scheiden extrazelluläre polymere Substanzen (EPS) wie Polysaccharide oder Proteine aus, die in Verbindung mit Wasser eine Hydrogel ausbilden. Bakterien können sich mithilfe des Biofilms vor den Wirkungen von Antibiotika schützen. Laut Müller kann Carolacton auch die Biofilmbildung von Streptococcus mutans, dem Hauptverursacher von Zahnkaries, reduzieren.
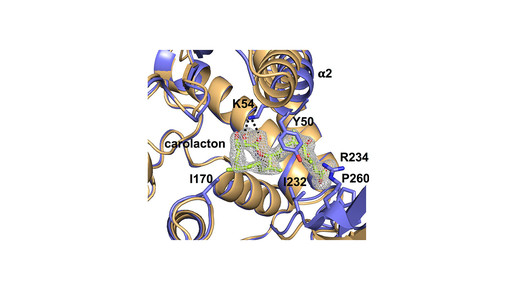
Den HIPS-Forschern ist es nun in Zusammenarbeit mit Professor Dr. Irene Wagner-Döbler vom HZI gelungen, die Wirkweise der Antibiofilm-Aktivität zu entschlüsseln, indem sie mittels der Modellorganismen Escherichia coli und Streptococcus pneumoniae das Target identifiziert haben. Ihren Ergebnissen zufolge kann Carolacton das Schlüsselenzym FolD des C1-Stoffwechsels hochspezifisch binden und es dadurch ausschalten. Das Enzym ist an der Bildung von Folsäure im C1-Stoffwechsel beteiligt. Die Kristallstruktur und die Bindeeigenschaften des Naturstoffs an FolD hat das Team um Dr. Jesko Köhnke, Leiter der Arbeitsgruppe „Strukturbiologie biosynthetischer Enzyme“, aufgeklärt.
„Der C1-Stoffwechsel zählt zu den wichtigsten Stoffkreisläufen und ist hochkonserviert durch alle Domänen des Lebens“, sagt Wagner-Döbler. Er stelle wichtige Bausteine des Wachstums bereit, wie etwa Nukleinsäuren, Aminosäuren und Provitamine. „Wir finden deshalb konservierte Gene für das Schlüsselenzym FolD in vielen verschiedenen Spezies, so auch in den Mitochondrien menschlicher Zellen“, erklärt die Professorin.
Durch den hohen Grad der Konservierung zwischen dem bakteriellen FolD-Enzym und dem menschlichen Enzym in Mitochondrien, vor allem im Bereich der Carolacton-Bindestellen, hemme der Naturstoff auch das Enzym der Mitochondrien. „Damit ist der Einsatz von Carolacton als Antibiotikum beim Menschen kaum vorstellbar“, sagt sie. Der Folsäure-Stoffwechsel ist essenziell für das Wachstum der meisten Lebewesen und auch für Menschen, da sie darüber DNA-Bausteine herstellen. Auch wenn ein therapeutischer Einsatz bei bakteriellen Infektionen nicht möglich ist, wäre aber eine Verwendung in der Krebstherapie denkbar. Denn FolD „wird in vielen Tumorzellen übermäßig produziert“, sagt Müller.
In ersten Versuchen konnten die Wissenschaftler die hemmende Effekte bei verschiedenen getesteten Krebszelllinien bereits zeigen. „Carolacton wäre daher ein sehr guter Ausgangspunkt für den Einsatz als Inhibitor in der Krebstherapie. Zukünftig müssen aber die pharmazeutischen Eigenschaften des Moleküls optimiert werden.“





















APOTHEKE ADHOC Debatte