Zwei Fragen an DrEd
Eine Stunde Zeit nahm sich der Gesundheitsausschuss des Bundestages für die 4. AMG-Novelle. Im Mittelpunkt der Anhörung der Gesundheitspolitiker standen die Regelungen zu klinischen Studien und die Rolle der neuen Ethik-Kommission. Apotheken- und Arzneithemen interessierten nur am Rande. Zwei Fragen zielten auf DrEd-Rezepte und jeweils eine auf das Berufsbild der Apotheker und die Arzneimittelsicherheit.
Von der ABDA und von der Bundesärztekammer (BÄK) wollte die gesundheitspolitische Sprecherin der Union, Maria Michalk (CDU), erfahren, wie sie zu Regelung des Fernbehandlungsverbotes stehen. Neues konnte Michalk der Antwort von ABDA-Vertreter Lutz Tisch nicht entnehmen. Der beabsichtige „direkte Patientenkontakt“ vor der Verordnung sei „rechtlich zulässig“, erklärte Tisch und außerdem politisch „richtig konzipiert“. Die Telemedizin sei kein Ersatz für den Arzt-Patienten-Kontakt, nur ein „add on“. Die gefundene Regelung biete genügend Spielraum. Wichtig sei der „unmittelbare Kontakt“. Tisch regte an, nochmals über die geänderte Formulierung „direkter“ Kontakt nachzudenken. Im Referentenentwurf lautete die Formulierung noch „persönlicher“ Kontakt.
Auch die BÄK hält einen „direkten“ Kontakt für notwendig. Für den von der Bundesregierung vorangetrieben Ausbau von E-Health sehe die BÄK darin kein Hindernis, sagte Professor Dr. Hans-Werner Bothe für die BÄK. Festhalten am Fernbehandlungsverbot will auch die Bundesarbeitsgemeinschaft Selbsthilfe (BAG Selbsthilfe). Deren Vertreterin Siiri Doka sieht darin ebenfalls auf Frage der SPD-Gesundheitspolitikerin Martina Stamm-Fibich keinen Widerspruch zum E-Health-Ausbau.
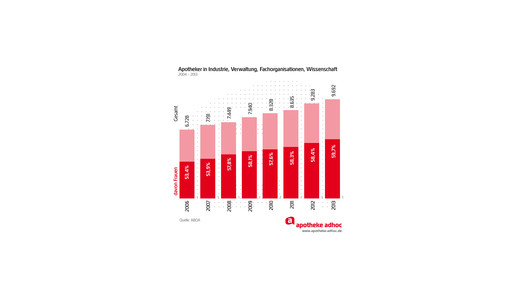
Kurz angeschnitten vom CDU-Abgeordneten Michael Hennrich wurde noch die Ergänzungen zum Berufsbild der Apotheker. Die Regelung sei „angezeigt und notwendig“, antwortete Tisch kurz und knapp. Die ABDA begrüße die Ergänzung „rundum“.
Vom Bundesverband der Pharmazeutischen Industrie (BPI) wollte die CDU-Abgeordnete Karin Maag wissen, ob die geplanten Maßnahmen zur Verbesserung der Arzneimittelsicherheit ausreichen. Die vorgesehene Verschärfung der Strafen sei nachvollziehbar, antwortete BPI-Vertreter Ulf Zumdick. Allerdings habe der BPI ein Problem mit der Fälschungs-Definition, die „sehr weit gefasst“ sei. Zumdick: „Schon wenn nur Papiere oder Belege falsch sind, gilt dies schon als Fälschung.“ Die Abgeordneten sollte noch einmal über die Definition nachdenken.
Der Bundesverband der Arzneimittel-Hersteller (BAH) forderte die Gesundheitspolitiker auf, die dreijährige Übergangsregelung für den Abverkauf bereits nach altem Recht produzierten Packungen zur Klarstellung im Gesetz festzuschreiben und auf den Februar 2019 zu datieren. Zudem mahnte der BAH eine Präzisierung an, zu welchen Zeitpunkt Arzneimittelrückrufe zu erfolgen hätten.
In ihrer schriftlichen Stellungnahme zur AMG-Anhörung hatte sich die ABDA bereits ausführlich zur vorgesehene Regelung zum Verbot von Online-Verschreibungen geäußert und dies als „sachgerecht“ bezeichnet. Mit der vorgesehenen Anpassung des Berufsbilds des Apothekers in der Bundesapothekerordnung greife die Politik eine langjährige Forderung der ABDA auf, heißt es darin.
Zunächst hatte Bundesgesundheitsminister allerdings eine nur eine enge Fassung des Berufsbildes entsprechend der EU-Vorgaben umsetzen wollen. In der AMG-Novelle wird die Erweiterung um apothekerliche Tätigkeiten in Lehre, Forschung und in Behörden verankert.
Der Entwurf für die 4. AMG-Novelle sieht vor, dass Apotheken ein verschreibungspflichtiges Arzneimittel nicht abgeben dürfen, wenn vor der Verschreibung „offenkundig kein direkter Kontakt“ zwischen dem Arzt und dem Patienten stattgefunden hat. Das zielt insbesondere auf die Online-Arztpraxis DrEd in London. Dort könne Patienten relativ einfach Rezepte nach Beantwortung eines Fragebogens erhalten.
Anders als die Verbraucherzentrale und die Versandapotheken sieht die ABDA im DrEd-Verbot keinen Konflikt mit dem EU-Recht. Es gebe keine unionsrechtlichen Bedenken, heißt es in dem Papier. Zwar müssten Apotheken in ganz Europa im Sinne der grenzüberschreitenden Versorgung Rezepte aus anderen Ländern anerkennen. „Den Mitgliedsstaaten wird aber gleichzeitig ausdrücklich die Option für Einschränkungen eingeräumt, die aus Gründen des Gesundheitsschutzes gerechtfertigt sind“, so die ABDA. Den Länder stehe ein weiter Ermessensspielraum zu. Zudem verweist die ABDA darauf, dass selbst die liberalen Niederlande Online-Rezepte wieder abgeschafft hätten. Nur in Großbritannien seien sie erlaubt.
Des weiteren wiederholt die ABDA in ihrer schriftlichen Stellungnahme ihre bekannten Honorarforderungen: Das Fixhonorar soll jährlich überprüft werden, die Rezepturgebühr soll auf das normale Fixhonorar von 8,51 Euro steigen und die BtM-Gebühr soll von 0,26 Euro auf 2,91 Euro steigen. Des Weiteren müsse der Zuschlag für die Notdienstpauschale um vier Cent auf 20 Cent steigen.
Inzwischen gilt jedoch als wahrscheinlich, dass die ABDA-Honorarforderungen nicht mehr im Rahmen der 4. AMG-Novelle erfüllt werden. Die Anpassung der Rezept- und BtM-Gebühren soll in einer noch folgenden Pharmadialog-Gesetzgebung erfolgen. Möglicherweise wir noch im Mai dazu ein Gesetzentwurf präsentiert.
Anfang März hatte das Bundeskabinett die 4. AMG-Novelle auf den parlamentarischen Weg gebracht. Verboten werden soll auch das Teleshopping mit Arzneimitteln. Änderungen gibt es auch für klinische Prüfungen mit Humanarzneimitteln. Die AMG-Novelle soll bereits im August 2016 in Kraft treten.
Im Heilmittelwerbegesetz (HWG) wird klargestellt, dass nicht nur die Werbung für das Teleshopping, sondern auch das Teleshopping selbst als besondere Ausprägung der Werbung verboten ist. Es wird zudem geregelt, dass das Teleshopping auch für Behandlungen durch Ärzte, Zahnärzte und Tierärzte verboten ist. Dies entspreche grundsätzlich bereits den Vorgaben in den einschlägigen Berufsordnungen. Das bisherige Verbot richtete sich nur gegen Werbung, Arzneimittel im Wege des Teleshopping zu beziehen und nicht gegen das Teleshopping selbst.
Mit den Anpassungen zu klinischen Prüfungen mit Humanarzneimitteln sind die Regeln für die Genehmigung, Durchführung und Überwachung von klinischen Prüfungen nun europaweit verbindlich vorgegeben. Es werden insbesondere die nationalen Zuständigkeiten und Verfahren für die Genehmigung klinischer Prüfungen geregelt: Die Ethik-Kommissionen der Länder werden weiterhin maßgeblich an der Genehmigung klinischer Prüfungen beteiligt. Zudem gelten für Prüfungsteilnehmer in Deutschland besondere Schutzvorschriften, wie das Erfordernis der Aufklärung der Prüfungsteilnehmer durch einen Arzt.
Die gruppennützige Forschung – also Forschung, die ausschließlich einen Nutzen für die Patientengruppe des Prüfungsteilnehmers hat – mit nicht einwilligungsfähigen Erwachsenen bleibt grundsätzlich verboten. Sie soll nur dann im Rahmen der engen Vorgaben des europäischen Rechts zulässig sein, sofern eine Patientenverfügung des Betreffenden dies ausdrücklich gestattet und der gesetzliche Betreuer auf der Basis der Patientenverfügung und nach umfassender Aufklärung in die konkrete klinische Prüfung einwilligt. Bei Menschen, die auch nach Erreichen der Volljährigkeit nicht einwilligungsfähig bleiben, ist eine gruppennützige klinische Prüfung weiterhin verboten, da diese Menschen keine Patientenverfügung abgeben können.






























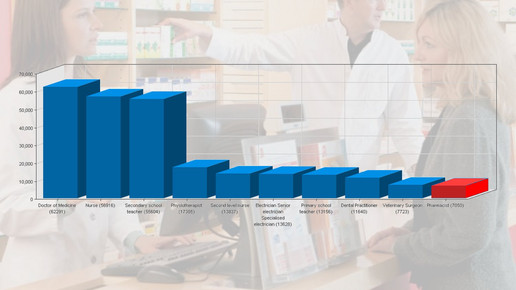



















APOTHEKE ADHOC Debatte