Protein schaltet das Immunsystem ab
Ein Forscherteam des Paul-Ehrlich-Instituts (PEI) hat einen Schlüsselfaktor identifiziert, der maßgeblich für die Vermehrung des HI-Virus verantwortlich ist. Der Faktor mit Namen NLRX1 gehört nicht zum Erreger, sondern ist Teil der menschlichen Zellen. Er verhindert die Aktivierung des Immunsystems gegenüber HIV-1.
HIV-1 nutzt menschliche Proteine für seine eigene Vermehrung und versteckt sich dadurch buchstäblich vor dem Immunsystem seines Wirtes. Dr. Renate König, Leiterin der Forschungsgruppe „Pathogen-Wirt-Interaktionen“ des PEI, und ihre Kollegen befassen sich schon lange mit der Frage, warum das menschliche Immunsystem bei HIV-1 versagt – selbst beim Eintritt der viralen RNA in die Zelle. Dies aufzuklären, könnte dazu beitragen, neue immunmodulierende Arzneimittel gegen HIV-1 oder Wirkverstärker für zukünftige Impfstoffen zu entwickeln.
In einer internationalen Kooperation mit Forschern aus den USA sind König und ihr Team jetzt einen wichtigen Schritt vorangekommen. Sie haben das Protein NLRX1 als wichtigen Akteur identifiziert. Die Abkürzung steht für „nucleotide-binding oligomerization domain, leucine rich repeat containing X1“. Der Faktor aus der sogenannten NOD-like-Rezeptorfamilie agiert dabei als Feinregulator: Er kann das Frühwarnsystem des Immunsystems abschalten. NLRX1 war bereits im Rahmen eines Hochdurchsatzverfahrens als eines von 295 potenziell für die HIV-1 Replikation bedeutsamen Proteinen identifiziert worden. Dass es tatsächlich eine ganz zentrale Rolle spielt und auf welche Weise, war bisher unbekannt.
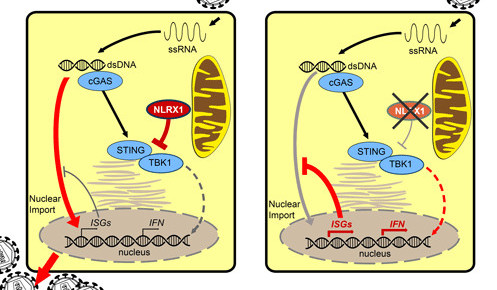
Die Wissenschaftler wiesen nach, dass NLRX1 die HIV-1-Infektion in Immunzellen ermöglicht, und zwar analog wie auch Makrophagen und dendritischen Zellen. NLRX1 hemmt das angeborene Immunsystem, indem es an ein weiteres Protein mit Namen STING (stimulator of interferon genes) bindet und dessen Aktivität verhindert.
STING ist normalerweise für die Bekämpfung von Viren ein wichtiger Akteur; in der Zelle übernimmt das Protein eine Vermittlerrolle: Nachdem die Virus-RNA im Zytoplasma in DNA umgeschrieben und erkannt worden ist, verbindet sich STING mit dem Tyrosinkinase-bindenden Faktor TBK1 und aktiviert ihn. In der Folge werden Typ-I-Interferon und proinflammatorische Zytokine gebildet. Zudem führt die Verbindung zwischen STING und TBK1 zu einer Aktivierung Interferon-stimulierender Gene, die das Einwandern der Virus-DNA in den Zellkern und damit seine Vermehrung verhindern.
Diese Abwehrmechanismen des Immunsystems werden gehemmt, wenn NLRX1 an STING bindet. Indem die Wissenschaftler NLRX1 ausschalteten, konnten sie zeigen, dass dem Protein tatsächlich eine Schlüsselrolle zukommt: Durch die Hemmung wurde die Zytokinantwort deutlich erhöht und das Einwandern der Virus-DNA in den Zellkern gehemmt.
Damit sei NLRX1 eine interessante Zielstruktur für die Entwicklung von Therapien gegen HIV-1, so die Forscher. Wenn es gelänge, neuartige Therapeutika zu entwickeln, die NLRX1 blockieren, könnten diese auch als Adjuvanzien für Impfstoffe genutzt werden. Das könnte die Wirksamkeit der Impfungen erhöhen, so die Hoffnung. „Wir glauben, dass durch unsere Forschungsergebnisse die Entwicklung solcher Wirkstoffe gegen HIV-1 beschleunigt werden kann, die dazu beitragen, die angeborene Immunantwort auf HIV-1 zu verstärken“, sagt König.





















APOTHEKE ADHOC Debatte