Eltern fordern AMNOG-Ausnahme für Epileptiker
Epileptische Anfälle können sich in der Symptomatik unterschiedlich ausdrücken. Entsprechend schwierig ist es, die Therapien zu vergleichen – doch genau das verlangt die frühe Nutzenbewertung. Der Epilepsie Bundes-Elternverband (e.b.e) forderte deshalb in einer Petition eine Reform des Arzneimittelmarkt-Neuordnungsgesetz (AMNOG), um alle therapieresistenten Patienten in Deutschland mit neuen Medikamenten versorgen zu können. Gestern hat der Petitionsausschuss das Thema in einer öffentlichen Sitzung erörtert.
Die Vorsitzende des e.b.e, Susanne Fey, hält es für problematisch, den individuellen Zusatznutzen für Epilepsie-Patienten in einer direkten Vergleichsstudie abzubilden. Das Problem: Es gebe keine bewährte Standardtherapie. Das Gesetz sei daher unbedingt zu erneuern, da der Gemeinsame Bundesausschuss (G-BA) epileptischen Arzneimitteln keinen Zusatznutzen ausspreche.
Neue Epilepsiemedikamente seien überall in Europa problemlos erhältlich – nur in Deutschland nicht, so der Verband. Außerdem würden nicht alle Kassen die Kosten für Antiepileptika übernehmen. Entweder seien sie nicht zugelassen oder die Krankheit würde nicht als lebensbedrohlich oder für die Lebensqualität beeinträchtigend eingestuft werden. Eine Nachbesserung des AMNOG sei deswegen dringend notwendig, so Fey.
Lösungsansätze für individualisierte Therapien sind ihrer Meinung nach bereits vorhanden. Zum einen könnte es eine Ausnahmeregelung für bestimmte Ärzte geben, sodass sie neue Epilepsiemittel verordnen dürften. Voraussetzung dafür könnte ein Zertifikat der Deutschen Gesellschaft für Epileptologie (DGFE) sein. Zum anderen könnten für schwerkranke Epileptiker, die auf bereits zugelassene Therapiemöglichkeiten nicht reagieren, Ausnahmen gemacht werden: Neue Medikamente für diese Patienten würden in eine Zusatznutzenkategorie fallen.
Beispielhaft stehen diesem Zusammenhang das sogenannte Nikolausurteil des Bundesverfassungsgericht (BVerfG) aus dem Jahr 2005: In Einzelfällen haben Patienten demnach Zugang zu Untersuchungs- und Behandlungsmethoden, die vom G-BA wegen fehlendem Zusatznutzen ausgeschlossen worden sind. Im Sozialgesetzbuch (SGB V) ist geregelt, dass Versicherte gesonderte Leistungen empfangen können, wenn sie an einer lebensbedrohlichen oder einer regelmäßig tödlichen Erkrankung leiden und „wenn eine nicht ganz entfernt liegende Aussicht auf Heilung oder auf eine spürbare positive Einwirkung auf den Krankheitsverlauf besteht“.
Im Petitionsausschuss wurde nun die Forderung nach einer Reform des AMNOG erörtert. Die Bundesregierung sei an einer „relevanten Erweiterung eines therapeutischen Spektrums“ interessiert, sagte die Parlamentarische Staatssekretärin beim Bundesgesundheitsministerium (BMG), Annette Widmann-Mauz (CDU) mit Blick auf den Pharmadialog.
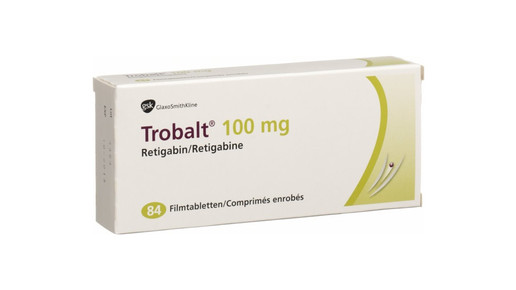
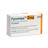
Seit Einführung des AMNOG wurden zwei wirksame Antikonvulsiva zugelassen, für die kein Zusatznutzen nachgewiesen werden konnte: Fycompa (Perampanel) von Eisai und Trobalt (Retigabin) von GlaxoSmithKline. Seit dem Vertriebsstopp in Deutschland sind beide nur als Einzelimport erhältlich. Eisai hatte Fycompa zunächst über ein spezielles Lieferprogramm kostenfrei abgegeben. Doch seit April müssen Patienten eine Genehmigung ihrer Krankenkasse einholen, um das Präparat als Einzelimport aus dem Ausland zu beziehen.



























APOTHEKE ADHOC Debatte