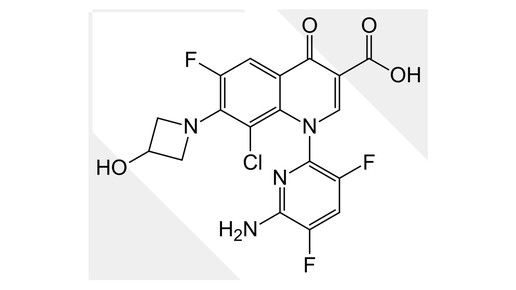
Delafloxacin: Menarini stellt Zulassungsantrag
Bald könnte ein neues Antibiotikum das Warenlager der Apotheken bereichern, denn der italienische Pharmakonzern Menarini hat kürzlich einen Zulassungsantrag bei der Europäischen Arzneimittelagentur (EMA) für Delafloxacin eingereicht.
Das Antibiotikum soll unter den Namen Quofenix vertrieben werden und in der Behandlung von erwachsenen Patienten mit akuten bakteriellen Haut- und Hautstrukturinfektionen (ABSSSI, Acute Bacterial Skin and Skin-Structure Infection) eingesetzt werden. Der Mutterkonzern von Berlin-Chemie rechnet damit, dass das europäische Zulassungsverfahren im zweiten Quartal 2019 abgeschlossen ist. In den USA ist das Mittel unter dem Namen Baxdela auf dem Markt.
Menari erhielt im Februar 2017 die Lizenz zur Vermarktung des Arzneimittels von Melinta Therapeutics. Im Rahmen der Entwicklungs- und Vermarktungsvereinbarung wurden die Rechte zur Vermarktung von Delafloxacin in 68 europäischen Ländern, im asiatisch-pazifischen Raum einschließlich China, Südkorea und Australien (ohne Japan) sowie in der Gemeinschaft Unabhängiger Staaten (GUS), einschließlich Russland, gewährt.
„Die Zulassungseinreichung von Delafloxacin in Europa ein Jahr nach Unterzeichnung des Abkommens stellt einen wichtigen strategischen Meilenstein für Menarini dar. ABSSSI gehören zu den häufigsten bakteriellen Infektionen beim Menschen und sind mit einer erheblichen Morbidität verbunden, insbesondere bei Patienten mit Grundleiden“, so Dr. Pio Mei, Geschäftsführer der Menarini Gruppe. Der Wirkstoff wird entweder als lyophilisiertes Pulver zur intravenösen Applikation mit 300 mg Delafloxacin (entsprechend 433 mg Delafloxacin-Meglumin) oder als Tablette mit 450 mg Delafloxacin (entsprechend 649 mg Delafloxacin-Meglumin) erhältlich sein.
Delafloxacin hat ein breites Wirkspektrum gegen grampositive Bakterien wie Strepto- und Staphylokokken und ist auch effektiv gegen den als Krankenhauskeim bekannten Methicillin-resistenten Staphylococcus aureus (MRSA). Zudem ist der Arzneistoff bei bakteriellen Infektionen einsetzbar, die auf gramnegative sowie atypische und anaerobe Organismen zurückzuführen sind.
Die Tabletten können mit oder ohne Nahrung eingenommen werden. Allerdings sollte ein Zeitabstand zu Magnesium- oder Aluminium-haltigen Antazida, Sucralfat, Eisen- oder Zink-haltigen Arzneimitteln und Multivitaminpräparaten eingehalten werden. Bei oraler Einnahme von Delafloxacin wird eine Dosis von zweimal täglich für eine Therapiedauer von fünf bis 14 Tagen empfohlen. Zu den häufigsten Nebenwirkungen zählen Übelkeit, Durchfall, Kopfschmerzen sowie Erbrechen.
Delafloxacin gehört zu den Fluorchinolonen, die die Aktivität das Enzyms Gyrase hemmen. In Deutschland sind weiterhin Ciprofloxacin, Norfloxacin, Enoxacin, Ofloxacin, Levofloxacin und Moxifloxacin aus dieser Gruppe der Antibiotika zugelassen. Fluorchinolone haben derzeit keinen guten Ruf, denn sie können irreversible Sehnenschäden, periphere Neuropathie und Auswirkungen auf das Zentralnervensystem haben. Die unerwünschte Arzneimittelwirkungen können bereits wenige Stunden nach der Einnahme oder auch Wochen nach Therapieende auftreten.

















APOTHEKE ADHOC Debatte