Zejula und Tookad empfohlen
Hoffnung gegen Ovarialkarzinom und Adenokarzinom der Prostata: Zejula und Tookad haben voder Europäischen Arzneimittelagentur (EMA) eine Zulassungsempfehlung erhalten. Gibt die EU-Kommission grünes Licht, könnten beide Onkologika demnächst in Europa verfügbar sein.
Zejula hatte bereits im Mai in den USA die Zulassung für die Erhaltungstherapie von erwachsenen Patientinnen mit rezidivierendem epithelialen Eierstock-, Eileiter- oder primärem Peritonealkarzinom erhalten, deren Tumore ganz oder teilweise auf eine Platin-basierte Chemotherapie ansprachen.
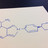
Niraparib ist ein Poly-ADP-Ribose-Polymerase-(PARP)-Inhibitor und verhindert, dass Krebszellen den durch Zytostatika verursachten DNA-Schaden reparieren können. Es kommt wahrscheinlich zum Tumorzelltod oder zu Verlangsamung und Stillstand der Krankheitsprogression. Daher kann das Orphan Drug zur Erhaltungstherapie nach einer vorangegangenen Chemotherapie eingesetzt werden. Die Wirksamkeit wurde in einer Phase-III-Studie bestätigt, die die Grundlage für die Zulassung in den USA war.
Zejula könnte demnächst auch in Europa als orale Darreichungsform zu 100 mg zur Verfügung stehen und neue Hoffnung für die betroffenen Frauen sein, deren relatives Fünf-Jahres-Überleben bei etwa 41 Prozent liegt. Das Arzneimittel wird einmal täglich eingenommen. Häufig beschriebene Nebenwirkungen während der Behandlung können beispielsweise Übelkeit, Anämie, Verstopfung, Erbrechen, Infektionen der Harnwege oder Muskelschmerzen sein.
Tookad (Padeliporfin, Steba Biotech) könnte demnächst als Monotherapie von Erwachsenen mit einem unbehandelten einseitigen Niedrigrisiko-Adenokarzinom der Prostata zur Verfügung stehen. Voraussetzung sind eine Lebenserwartung von zehn Jahren sowie weitere Kriterien wie klinische Stufe T1c oder T2a, ein Gelasoon Score ≤ 6, basierend auf hochauflösenden Biopsie-Strategien, ein prostataspezifischer Antigen (PSA)-Wert ≤ 10 ng / ml sowie drei positiven Krebskerne.
Das Arzneimittel soll voraussichtlich auf den Krankenhausgebrauch beschränkt werden. Tookad könnte als Pulver zu 183 mg und 366 mg für die Herstellung einer Injektionslösung zur Verfügung stehen und in der photodynamischen Therapie (VTP) eingesetzt werden. Padeliporfin zählt zu den Photosensibilatoren und wird unter Laserlicht aktiviert. In der Folge wird eine Kaskade von pathophysiologischen Ereignissen angestoßen, die innerhalb weniger Tage zu einer fokalen Nekrose führen. Innerhalb kurzer Zeit kommt es zu einem fokalen Verschluss der Tumorgefäße, wodurch das befallene Areal ausgeschalten wird.
Die Behandlung findet unter Vollnarkose statt. In die Prostata wird ein Lichtleiter eingeführt sowie Tookad intravenös injiziert. Anschließend findet lokal eine Aktivierung des Wirkstoffes durch Licht statt.
















APOTHEKE ADHOC Debatte