Antikörper-Therapien: Noch kein Zulassungsprozess in EU
In den USA bereits zugelassene Antikörper-Therapien gegen Covid-19 lassen in der EU weiter auf sich warten. Bislang läuft für keines der Mittel ein Zulassungsprozess bei der Europäischen Arzneimittel-Agentur (EMA), wie aus Angaben auf der Behörden-Webseite hervorgeht.
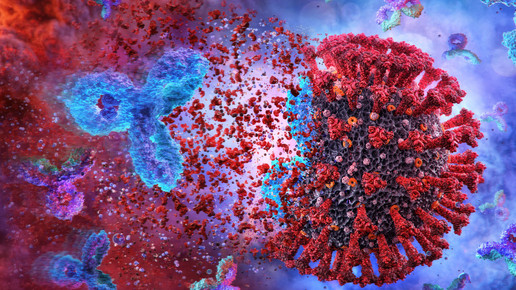
In den USA haben zwei solcher Therapien seit November eine Notfall-Zulassung. Sie basieren auf sogenannten monoklonalen Antikörpern, die im Labor hergestellt werden und das Virus nach einer Infektion außer Gefecht setzen. Die Mittel der Firmen Regeneron und Eli Lilly dürfen in den USA zur Behandlung von Patienten ab zwölf Jahren eingesetzt werden, bei denen das Risiko besteht, dass sie schwere Covid-19-Symptome entwickeln. Am stärksten profitieren Regeneron zufolge Probanden, deren Immunsystem noch keine eigenen Antikörper gegen das Virus gebildet hat.
Unter dem Namen „Regn-CoV2“ hat der Hersteller die beiden Antikörper Casirivimab und Imdevimab zusammengefasst. Die Behandlung ist bei leichten und mittleren Erkrankungsverläufen von Covid-19 indiziert. Patienten, die sich im Krankenhaus befinden oder Sauerstoff benötigen, dürfen das Medikament nicht bekommen. In der Vergangenheit konnte Regeneron bereits häufiger positive Daten für den Antikörper-Cocktail liefern. Regeneron plant, gemeinsam mit dem Pharmakonzern Roche als Partner, auch in der EU Zulassungen zu beantragen.
Auch Lilly hat in den USA bereits die Notfallzulassung für einen Antikörper gegen Covid-19. Der Antikörper „LY-CoV555“ (Bamlanivimab) ist aus einer Zusammenarbeit entstanden: Nachdem der Antikörper von Abcellera entdeckt und vom NIAID Vaccine Research Center getestet wurde, entwickelte Lilly ihn innerhalb von knapp drei Monaten weiter. Ursprünglich stammt er aus einer Blutprobe von einem genesenen Covid-Patienten. Es handelt sich dabei um einen neutralisierenden monoklonalen IgG1-Antikörper, der gegen das Spike-Protein von Sars-CoV-2 gerichtet ist. Durch den Antikörper soll die Anhaftung des Virus und der Eintritt in menschliche Zellen blockiert werden.
Die Frankfurter Virologin Sandra Ciesek geht – auch wegen der komplizierten und teuren Produktion – absehbar davon aus, dass „das wahrscheinlich eher ein Einsatz ist, der sehr kontrolliert erfolgen wird, zum Beispiel bei Hochrisikopatienten, aber sicherlich nicht bei jedem durchführbar sein wird“.



















APOTHEKE ADHOC Debatte