Weiterer Zulassungsantrag für Xarelto
Es geht Schlag auf Schlag: Erst vor wenigen Wochen hat Bayer für Rivaroxaban eine neue Indikation zugesprochen bekommen. Nun geht es für den Blockbuster in eine weitere Prüfung – Bayer hat einen Zulassungsantrag für den europäischen Markt gestellt.
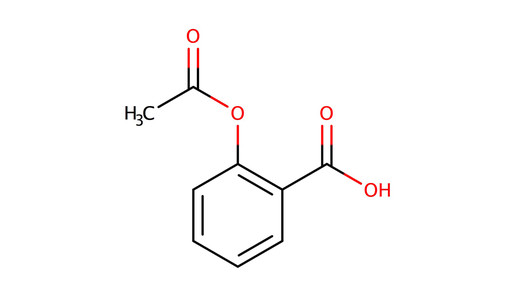
Bayer hat bei der Europäischen Arzneimittelagentur (EMA) für Rivaroxaban einen Zulassungsantrag in der vaskulären Dosierung gestellt. Grundlage sind die Ergebnisse der klinischen Studie mit dem Namen Compass. Xarelto wird in dieser Indikation zweimal täglich zu 2,5 mg in Kombination mit einmal täglich 100 mg Acetylsalicylsäure (ASS) verabreicht. Die Gabe führte zu einer Verminderung des kombinierten Risikos für Schlaganfälle, Herzinfarkte und kardiovaskuläre Todesfälle um 24 Prozent. Bayer beantragt eine Zulassung für die Kombination zur Behandlung der chronischen koronaren Herzkrankheit (KHK) oder der peripheren arteriellen Verschlusskrankheit (pAVK).
Bei positivem Urteil wäre das Arzneimittel in der vaskulären Dosierung in Kombination mit ASS der einzige nicht-Vitamin-K-basierte orale Gerinnungshemmer (NOAK), der für die Patientengruppe zugelassen ist.
Ende August meldete Bayer den Erfolg für die Compass-Studie. Die großangelegte klinische Untersuchung zählte 27.400 Probanden in mehr als 60 Ländern und startete 2013. Die gelieferten Daten belegten, dass Xarelto in Kombination mit ASS das Risiko von Schlaganfällen und Infarkten bei chronisch herz- und gefäßkranken Patienten deutlich senken kann.
Bei der untersuchten Dosierung konnte außerdem eine Senkung des Schlaganfall-Risikos um 42 Prozent gezeigt werden – im Vergleich zu ASS allein. Die Studienergebnisse wurden im „New England Journal of Medicine“ veröffentlicht.
Rivaroxaban ist ein hoch selektiver, direkter Inhibitor von Faktor Xa. Die Hemmung unterbricht den intrinsischen und extrinsischen Weg der Blutgerinnungskaskade. Die Bildung von Thrombin und Thrombenbildung werden gehemmt. Auf die Thrombozyten nimmt der Arzneistoff keinen Einfluss. Der Blockbuster besitzt unter den NOAK die meisten Zulassungen. Insgesamt ist das Arzneimittel in sieben Indikationen und mehr als 130 Ländern zugelassen, wobei der Zulassungsstatus von Land zu Land variiert.
Xarelto kann zur Prävention von Schlaganfällen und systemischen Embolien bei Erwachsenen mit nicht-valvulärem Vorhofflimmern und einem oder meheren Risikofaktoren eingesetzt werden. Außerdem ist das Arzneimittel für die Behandlung und Prävention von Lungenembolien und tiefen venösen Venenthrombosen bei Erwachsenen zugelassen. Ebenso kann das Arzneimittel zur Prävention venöser Thromboembolien nach elektiver Hüftgelenks- und Kniegelenksersatzoperation angewendet werden. Die siebte Indikation ist die Prävention atherothrombotischer Ereignisse nach einem akutem Koronarsyndrom bei Patienten mit erhöhten kardialen Biomarkern ohne vorherigen Schlaganfall oder vorübergehende ischämische Attacke in Kombination mit ASS oder mit ASS und Clopidogrel oder Ticlopidin.
Zuletzt hatte Xarelto 10 mg die Zulassung in der einmal täglichen Dosierung für die Langzeittherapie rezidivierender venöser Thrombosen (VTE) erhalten und kann so zur verlängerten Prävention der VTE verabreicht werden. Anwendung findet Xarelto 10 mg bei Patienten, die nach einem thromboembolischen Ereignis bereits mindestens sechs Monate ein Standard-Antikoagulans erhalten haben. Im Vergleich zu Acetysalicylsäure (ASS) 100 mg konnte Rivaroxaban 10 mg das Risiko erneut auftretender Thromboembolien im Anschluss an die mindestens sechsmonatige Standardtherapie signifikant senken. Ärzte können nun neben Xarelto 20 mg mit der neuen Therapieoption zu 10 mg bei gleicher Indikation behandeln.
Die Ergebnisse der Phase-III-Studie Einstein Choice wurden im „New England Journal of Medicine“ (NEJM) veröffentlicht. Die etwa 3400 Probanden erhielten entweder 10 oder 20 mg Rivaroxaban oder 100 mg ASS. Vor Studienbeginn erhielten die Teilnehmer zwischen mindestens sechs und zwölf Monaten eine gerinnungshemmende Therapie zur Behandlung einer Lungenembolie oder einer tiefen Venenthrombose. Die Wirksamkeit wurde am primären Endpunkt „symptomatische rezidivierende tödliche oder nicht tödliche VTE“ gemessen. Für Rivaraxaban 20 mg wurde der primäre Endpunkt bei 1,5 Prozent der Probanden erreicht. Rivaroxaban zu 10 mg steht dem mit 1,2 Prozent entgegen und ASS mit 4,4 Prozent.
Anfang Oktober brach Bayer eine Phase-III-Studie ab: Navigate Esus sollte die Überlegenheit von Xarelto gegenüber ASS bei Patienten mit embolischem Schlaganfall unklarer Ursache belegen. Eine Zwischenanalyse führte jedoch zum vorzeitigen Aus. Die Studie untersuchte die Sicherheit und Wirksamkeit von Rivaroxaban zur Sekundärprävention von Schlaganfällen und systemischen Embolien bei ESUS-Patienten.
Die Wirksamkeit von Rivaroxaban war jedoch mit ASS vergleichbar, daher gab es „nur geringe Aussichten auf einen klinischen Nutzen bei Fortsetzung der Studie“, so Bayer. „Die Blutungsraten waren insgesamt niedrig. In der Rivaroxaban-Gruppe waren sie höher als in der Gruppe, die mit niedrig dosiertem ASS behandelt wurde.“























APOTHEKE ADHOC Debatte