Symbioflor: Indikation gestrichen
Eine schlechte Nachricht hat die Europäische Arzneimittelagentur (EMA) für Hersteller Symbiopharm. Symbioflor 2 soll nicht mehr bei funktionellen gastrointestinalen Störungen angewendet werden – einem Indikationsgebiet laut Packungsbeilage.
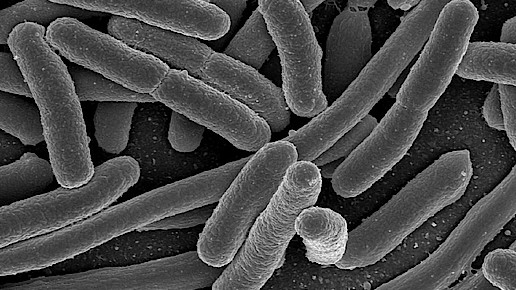
Symbioflor 2 enthält das Bakterium Escherichia coli, das als Probiotikum eingesetzt wird und das Wachstum von nützlichen Darmbakterien anregen soll. Das Präparat ist in Deutschland bereits seit den 50-er Jahren auf dem Markt. Symbioflor 2 ist auch in Österreich und Ungarn erhältlich und wird zur Stärkung des Immunsystems und zur Behandlung funktioneller Magen-Darm-Störungen eingesetzt.
Die Überprüfung des Präparates wurde im vergangenen Jahr angestoßen. Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) hatte die Untersuchung bei der EMA beantragt. Man habe Zweifel, dass die Wirksamkeit des Produktes in klinischen Studien adäquat demonstriert worden sei, hieß es. Eine ineffektive Behandlung führe bei den betroffenen Patienten zu einer deutlich verlängerten Leidenszeit und verringere die Lebensqualität. Das BfArM hatte daher darum gebeten, die wissenschaftliche Grundlage für die Zulassung des Magen-Darm-Mittels zu untersuchen. Durchgeführt wurde die Bewertung vom Ausschuss für Humanarzneimittel (CHMP). Eine endgültige Entscheidung wird von der EU-Kommission getroffen.
Der CHMP stützt sich in seiner Beurteilung auf alle zur Verfügung stehenden Daten zur Sicherheit und Wirksamkeit von Symbioflor 2. Eingeschlossen in die Bewertung sind Ergebnisse aus klinischen Studien, wissenschaftlichen Publikationen sowie Erfahrungen nach der Vermarktung und Informationen des Herstellers. Die Experten kamen zu dem Schluss, dass das Präparat sicher ist und keine neuen Beweise für eine Wirksamkeit vorliegen.
Auch eine randomisierte Studie mit etwa 300 Erwachsen zur Wirksamkeit der Behandlung bei einem Reizdarmsyndrom (IBS) hatte Schwächen. Bei Kindern mit IBS war laut Experten kein Vorteil zu erkennen. Die vorliegenden Studien sind nicht ausreichend, um beurteilen zu können, ob Symbioflor 2 bei einer bestimmten Art der IBS wirksam ist.
Daher hat der CHMP den Hersteller aufgefordert, eindeutige Daten aus Studien zu liefern, die die Sicherheit und Wirksamkeit des Arzneimittels belegen. Die Probanden sollten an unterschiedlichen Symptomen wie Durchfall oder Verstopfung leiden. Das Einreichen der Studiendaten an die nationalen Behörden ist die Voraussetzung für die Zulassung.
Symbioflor 2 sollte nicht mehr zur Behandlung von funktionellen gastrointestinalen Störungen angewendet werden, denn die Erkrankung kann unterschiedliche Ursachen haben und daher unterschiedliche Behandlungsansätze erfordern. Symbiopharm wird die Indikation „funktionelle gastrointestinale Störungen“ verlieren und muss die Produktinformation anpassen.
























APOTHEKE ADHOC Debatte