EMA: Widerruf der Zulassungen empfohlen
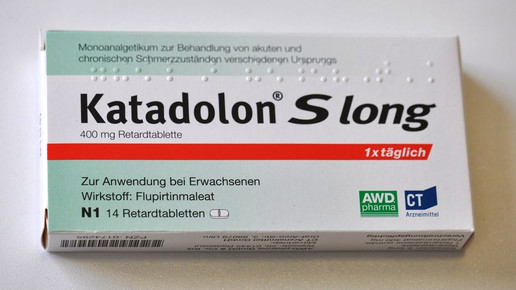
Aus für Katadolon? Das im Oktober eingeleitete Risikobewertungsverfahren flupirtinhaltiger Arzneimittel findet sein erstes Zwischenergebnis. Der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) der Europäischen Arzneimittelagentur (EMA) empfiehlt den Widerruf der Zulassungen.
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) hatte die Prüfung angestoßen. Die EMA knüpfte an ein Risikobewertungsverfahren aus dem Jahr 2013 an. Schon damals lagen den Experten Berichte schwerwiegender Leberprobleme im Zusammenhang mit der Einnahme von flupirtinhaltigen Arzneimitteln vor. Man beschloss eine Beschränkung der Anwendungsdauer auf zwei Wochen und beschnitt die Indikation der Arzneimittel auf Patienten, bei denen andere Arzneimittel wie Opioide oder nichtsteroidale Antirheumatika (NSAR) nicht angewendet werden können. Außerdem sollten Laborkontrollen der Leberwerte während der Therapie durchgeführt werden.
Das Zwischenergebnis der zweiten Bewertung seitens der EMA ist weitaus strenger. Nun sollen die Zulassungen widerrufen werden, denn die eingeführten Maßnahmen würden nicht ausreichend beachtet, so das Ergebnis einer Kontrollstudie der EMA. Zwar war die Zahl der Patienten, die mit flupirtinhaltigen Arzneimitteln behandelt wurden rückläufig, dennoch wurden weiterhin Meldungen zu schwerwiegenden Leberschädigungen im Zusammenhang mit den Präparaten dokumentiert. Somit lautet der Beschluss des PRAC: Patienten, die mit Flupirtin behandelt werden, sind weiterhin schwerwiegenden Risiken ausgesetzt, die den Nutzen der Präparate überwiegen.
Die Empfehlung des PRAC ist jedoch noch nicht rechtskräftig. Nun wird die Entscheidung an die Koordinierungsgruppe für dezentrale Verfahren und Verfahren der gegenseitigen Anerkennung (CHDh) weitergeleitet. Wird die Position des Ausschusses nicht eindeutig getroffen, wird die Europäische Kommission einen rechtlich verbindlichen Beschluss vorlegen.
Flupirtin ist ein nicht-opioides zentral wirksames Analgetikum. Dem Arzneistoff werden muskelentspannende und schmerzstillende Eigenschaften zugesprochen. Außerdem soll Flupirtin Einfluss auf das Schmerzgedächtnis nehmen. Enthalten ist der generische Wirkstoff beispielsweise in Katadolon (Teva). Flupirtin aktiviert G-Protein-gekoppelte, einwärts gleichgerichtete Kaliumkanäle der Nervenzelle. Die Kanäle öffnen sich und Kalium strömt ein. Die Aktivierung der Nervenzellmembran wird herabgesetzt. Indirekt kommt es zur Hemmung der Aktivierung von NMDA-Rezeptoren. Flupirtinhaltige Arzneimittel können drei- bis viermal täglich zu je 100 mg bei gleichem Zeitabstand eingenommen werden. Die Tageshöchstdosis beträgt 600 mg – bei schweren Schmerzuständen können Betroffene dreimal täglich 200 mg Flupirtin einnehmen.
Gebrauchsinformationen flupirtinhaltiger Arzneimittel sind mit einem „▼“ gekennzeichnet. Das Symbol zeigt, dass die Arzneimittel einer zusätzlichen Überwachung unterliegen. Menschen mit bestehender Lebererkrankung, Alkoholiker oder Patienten, die bereits andere hepatotoxisch wirkende Medikamente nehmen, sollen gar nicht mit Flupirtin behandelt werden.













APOTHEKE ADHOC Debatte