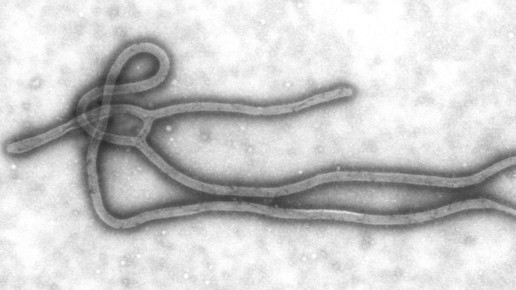
Ebola: Bedingte Genehmigung für Impfstoff empfohlen
Die Europäische Arzneimittelagentur (EMA) hat die bedingte Zulassung des Lebendimpsftoffes Ervebo (rVSVΔG-ZEBOV-GP) empfohlen. Die bislang schwerste Ebola-Epidemie brach 2014 in Westafrika aus; seit 2018 gibt es im Kongo und in Uganda eine neue Welle. Das positive Votum aus Amsterdam soll ein Signal sein, damit der Impfstoff schnell auch in Afrika zum Einsatz kommen kann.
Ervebo ist der erste Impfstoff zur aktiven Immunisierung von Personen ab 18 Jahren, die einem Infektionsrisiko mit dem Ebola-Virus ausgesetzt sind. Der Impfstoff hat sich als sicher wirksam gegen Ebola erwiesen. Es handelt sich um einen gentechnisch veränderten, replikationskompetenten, abgeschwächten Lebendimpfstoff. Daten aus klinischen Studien haben gezeigt, dass sich der Mensch nach einmaliger Gabe nicht mehr mit dem Virus anstecken kann.
Die klinische Entwicklung eines Impfstoffes wurde als Reaktion auf den Ausbruch 2014 in Zusammenarbeit mit verschiedenen Interessengruppen des öffentlichen Gesundheitswesens eingeleitet. Während des aktuell anhaltenden Ebola-Ausbruchs in der Demokratischen Republik Kongo wird der Impfstoff im Rahmen eines erweiterten Zugangsprotokolls eingesetzt, um Personen mit dem höchsten Infektionsrisiko zu schützen.
Ervebo wurde an rund 16.000 Personen im rahmen klinischer Studien in Afrika, Europa und den USA getestet. Vorläufige Daten zeigen, dass der Impfstoff beim gegenwärtigen Ausbruch wirksam ist. Zusätzliche Daten zur Wirksamkeit und Sicherheit werden im Rahmen des erweiterten Zugangsprotokolls gesammelt und kontinuierlich überprüft. Der Impfstoff wurde durch das Priority Medicines-Programm (Prime) der EMA unterstützt, das eine frühzeitige und verbesserte wissenschaftliche und behördliche Unterstützung für Medikamente bietet, die ein besonderes Potenzial haben, um einen notwendigen medizinischen Bedarf zu decken. „Die positive Stellungnahme der EMA für den ersten Impfstoff gegen das Ebola-Virus zeigt, dass die wissenschaftliche Expertise in der EU genutzt werden kann, um die Auswirkungen tödlicher Krankheiten wie Ebola zu verringern“, sagte der Vorsitzende des zuständigen EMA-Ausschusses CHMP, Harald Enzmann.
Ervebo erhielt eine positive Stellungnahme zu einer bedingten Genehmigung für das Inverkehrbringen, da weitere Informationen zum Herstellungsprozess erst in den kommenden Monaten übermittelt werden können. Dies wurde angesichts der anhaltenden gesundheitlichen Notlage in der Demokratischen Republik Kongo als angemessen erachtet. Die Stellungnahme der EMA wird nun der EU-Kommission zur Annahme eines Beschlusses über eine EU-weite Genehmigung für das Inverkehrbringen übermittelt.
„Dies ist ein wichtiger Schritt, um die Last dieser tödlichen Krankheit zu lindern“, betonte EMA-Direktor Guido Rasi. „Die Empfehlung des CHMP ist das Ergebnis langjähriger gemeinsamer, weltweiter Bemühungen, neue Medikamente und Impfstoffe gegen Ebola zu finden und zu entwickeln. Die Gesundheitsbehörden in den von Ebola betroffenen Ländern benötigen sichere und wirksame Arzneimittel, um auf Ausbrüche reagieren und Leben retten zu können.“
Im Juli 2019 stufte die Weltgesundheitsorganisation (WHO) den anhaltenden Ebola-Ausbruch im Kongo als Notfall von internationaler Bedeutung ein. Über zwei Drittel aller aktuellen Neuansteckungen verlaufen tödlich. Bislang sind mehr als 3000 Menschen im Kongo infiziert worden.
Ebola ist eine seltene, aber schwere virale Infektionskrankheit. Die Sterberate in den einzelnen Epidemiegebieten schwankt zwischen 25 und 90 Prozent. In Westafrika starben zwischen 2014 und 2016 mehr als 11.000 Menschen an den Folgen der Infektion. Derzeit sind keine Therapien für Ebola zugelassen.
















APOTHEKE ADHOC Debatte