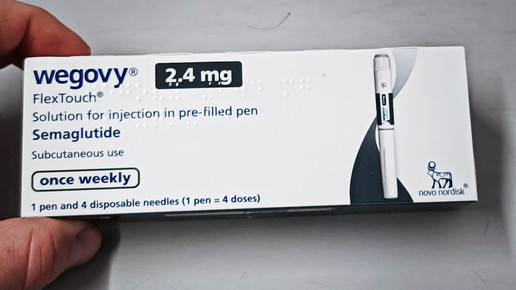
Neue Indikation für Wegovy
Novo Nordisk hat von der US-Arzneimittelbehörde FDA eine zusätzliche Zulassung für Wegovy (Semaglutid 2,4 mg) erhalten. Damit erweitert sich der Einsatzbereich des Präparats auf eine Lebererkrankung, über die derzeit auch in der Europäischen Union (EU) entschieden wird. Grundlage der FDA-Entscheidung sind Zwischenergebnisse aus der Essence-Studie.
Die Zulassung betrifft die Behandlung von nichtzirrhotischer, stoffwechselbedingter Steatohepatitis (MASH) bei Erwachsenen mit moderater bis fortgeschrittener Leberfibrose (Stadien F2 bis F3) in Kombination mit einer kalorienreduzierten Ernährung und erhöhter körperlicher Aktivität.
Entscheidung auf vorläufiger Basis
Die beschleunigte Zulassung im Rahmen des FDA-Programms Accelerated Approval stützt sich auf Ergebnisse aus dem ersten Teil der Essence-Studie, einer Phase-3-Erhebung mit einer Zielgröße von 1200 Teilnehmenden. Sie wurden im Verhältnis 2:1 randomisiert: Zwei Drittel der Teilnehmenden erhielten einmal wöchentlich Semaglutid 2,4 mg, ein Drittel bekam Placebo. Beide Gruppen wurden zusätzlich nach der üblichen Standardtherapie behandelt, und die Behandlung lief über 240 Wochen.
Der erste Teil der Untersuchung bewertete nach 72 Wochen die Leberhistologie bei den ersten 800 Patientinnen und Patienten anhand von Biopsien. Wegovy zeigte dabei eine statistisch signifikante Verbesserung der Leberfibrose ohne Verschlechterung der Steatohepatitis sowie eine Auflösung der Steatohepatitis ohne Verschlechterung der Fibrose.
Deutliche Vorteile gegenüber Placebo
Nach 72 Wochen erreichten 36,8 Prozent der mit Wegovy behandelten Personen eine Verbesserung der Leberfibrose ohne Verschlechterung der Steatohepatitis, während es in der Placebo-Gruppe 22,4 Prozent waren. Eine Auflösung der Steatohepatitis ohne Verschlechterung der Fibrose wurde bei 62,9 Prozent der Behandelten beobachtet, verglichen mit 34,3 Prozent unter Placebo.
Der zweite Teil der Studie untersucht, ob Semaglutid über 240 Wochen hinweg das Risiko leberbezogener klinischer Ereignisse reduziert. Ergebnisse dazu werden 2029 erwartet. Auf Basis der Resultate aus dem ersten Teil hat Novo Nordisk im Februar 2025 einen Zulassungsantrag in der Europäischen Union und im Mai 2025 in Japan eingereicht.
„Wegovy ist nun einzigartig positioniert als die erste und einzige GLP-1-Therapie mit Zulassung für MASH und ergänzt damit den bereits nachgewiesenen Nutzen für Gewichtsreduktion, kardiovaskuläre Gesundheit und die umfangreiche Evidenzbasis für Semaglutid“, sagte Martin Holst Lange, Executive Vice President, Chief Scientific Officer und Leiter Forschung & Entwicklung bei Novo Nordisk.
Was ist MASH?
MASH ist die Abkürzung für „Metabolic dysfunction-associated steatohepatitis“, eine Form der Fettleberentzündung, die durch Stoffwechselstörungen entsteht und eng mit Übergewicht oder Adipositas verbunden ist. Weltweit sind mehr als 250 Millionen Menschen betroffen.
Laut Novo Nordisk wird sich die Zahl der Erkrankten in fortgeschrittenen Stadien bis 2030 voraussichtlich verdoppeln. In frühen Stadien verursacht MASH meist keine oder nur unspezifische Symptome wie Müdigkeit oder ein Druckgefühl im Oberbauch, was eine frühe Diagnose erschwert. Ohne Behandlung kann die Krankheit fortschreiten und zu schweren Leberschäden bis hin zu Leberkrebs führen.


















APOTHEKE ADHOC Debatte