„MCP-Revival nicht zu erwarten“
MCP-Tropfen kommen zurück in die Apotheke. Das Antiemetikum wurde von vielen Apothekern und Patienten vermisst. Experten von der Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) sind ob des Erfolgs des neuen Produktes dennoch skeptisch, da wichtige Indikationen weggefallen sind.
Aus der Sicht von AkdÄ-Vorstandsmitglied Professor Dr. Daniel Grandt werden MCP-Tropfen nicht mehr die gleiche Schlagkraft entwickeln wie vor dem Rückruf: „Ein wesentlicher Teil des Einsatzgebietes von MCP wurde grundsätzlich von der EMA ausgeschlossen“, sagt Grandt.
MCP dürfe etwa nicht mehr bei gastrointestinalen Motilitätsstörungen, Dyspepsie oder bei Kindern unter ein Jahr eingesetzt werden, so Grandt. „Bei den übrigen Indikationen sprechen wir von nur einem kleinen Einsatzbereich“, so der Chefarzt der Klinik für Innere Medizin am Klinikum Saarbrücken. Ein „Revival“ von MCP sei daher nicht zu erwarten.
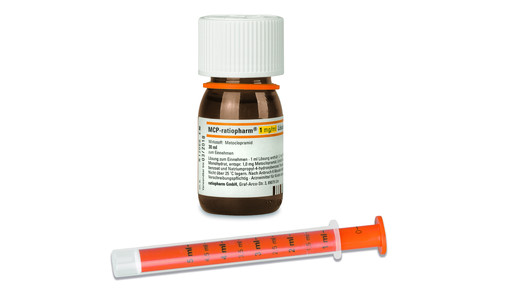
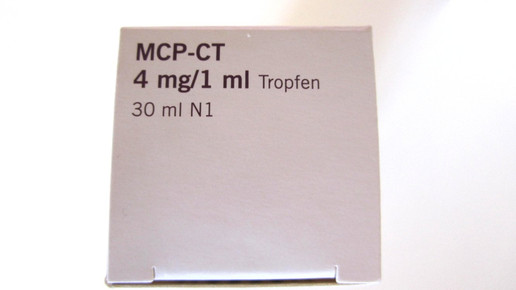
Im August bringen die Teva-Töchter Ratiopharm und AbZ neue MCP-Tropfen auf den Markt. Indikationen und Therapiedauer wurden verändert. Sämtliche Indikationen für chronische Beschwerden sind als Folge des Widerrufs der Zulassung entfallen. Die MCP-Lösung 1 mg/ml ist bei Erwachsenen nun zur Vorbeugung von und nach Chemotherapie verzögert auftretender Übelkeit und verzögert auftretendem Erbrechen zugelassen, ebenso zur Vorbeugung dieser Symptome, die durch Strahlentherapie oder akute Migräne verursacht werden.
Bei der Behandlung von Tumorpatienten haben die Tropfen laut Grandt gefehlt: „Es gibt weitere Wirkstoffe, die bei chronischer Übelkeit gut wirksam sind. MCP ist jedoch ein Mosaikstein des Gesamtkomplexes“, so Grandt.
Dass die Therapie mit MCP von pflanzlichen Arzneimitteln ersetzt werden kann, glaubt er nicht: „Gerade im Bereich gastrointestinale Motilitätsstörungen gibt es kaum Arzneimittel mit Studienbelegen über die Wirksamkeit. Hier gibt es derzeit eine therapeutische Lücke.“
Überdosierungen befürchtet sein Kollege bei der AkdÄ, Professor Dr. Bernd Mühlbauer, nicht mehr: „Ich begrüße die neuen Zulassungen, da die Arzneimittelsicherheit insbesondere für Kinder erhöht wurde. Bei etwa einem Fünftel der bisherigen Konzentration können Kinder nicht mehr zu Schaden kommen, selbst wenn sie 50 Tropfen verabreicht bekommen.“ Erwachsene Anwender werden laut Mühlbauer vermutlich die gleiche Tropfenanzahl wie vorher einnehmen. „Damit werden die meisten wegen des Placeboeffekts zufrieden sein“, sagt er.
Mühlbauer, Direktor des Instituts für Klinische Pharmakologie am Klinikum Bremen Mitte, hätte sich allerdings eine höhere Altersbeschränkung für Kinder gewünscht. „Ein höheres Grenzalter von zum Beispiel zwölf Jahren wäre rigider gewesen.“ Ein Onkologe werde MCP-Tropfen in diesen neuen Konzentration vermutlich nicht verschreiben, da die Dosierung zu niedrig sei. „Der Arzt wählt dann die höher dosierten Tabletten.“
Mühlbauer hatte den unkritischen Umgang einiger Ärzte mit den alten Tropfen moniert: „Dass der Wirkstoff in Misskredit gekommen ist, ist nicht zuletzt dem übertriebenen Einsatz zu verdanken“, so Mühlbauer. „Die Zulassungseinschränkung wäre nicht nötig gewesen, wenn die Ärzte mit MCP stringenter umgegangen wären“, sagte Mühlbauer nach dem Rückruf im vergangenen Jahr.
Die Europäische Arzneimittelagentur (EMA) hatte im Dezember 2011 eine Risikobewertung für alle MCP-Monopräparate durchgeführt. Im Juli 2013 legten die Experten ihre Empfehlungen mit Beschränkungen für den Einsatz vor. Die EMA entschied im Oktober, dass alle Lösungen mit mehr als 1mg/ml Wirkstoff wegen der potenziellen Risiken außer Handel genommen werden sollten. Eine entsprechende Empfehlung der EU-Kommission aus dem Dezember 2013 wurde hierzulande mit dem BfArM-Bescheid vom 15. April 2014 umgesetzt. Davon waren alle in Deutschland erhältlichen Tropfen betroffen, denn gängig waren die Wirkstoffkonzentrationen von 4 oder 5 mg/ml.
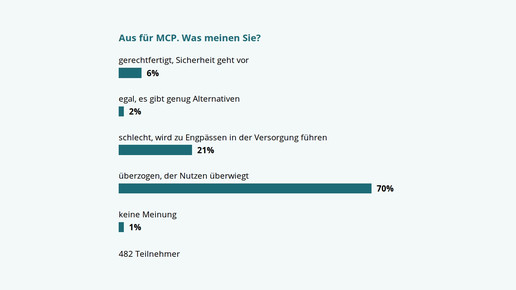
+++ APOTHEKE ADHOC Umfrage +++
MCP kommt zurück. Was erwarten Sie? Jetzt abstimmen! »

























APOTHEKE ADHOC Debatte