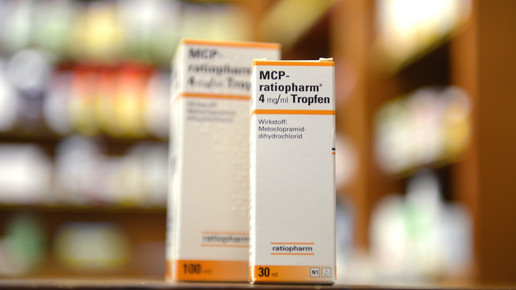
MCP vor dem Comeback
Knapp ein Jahr ist es her, dass Tropfen mit Metoclopramid (MCP) über Nacht vom Markt verschwanden. Nun könnte es ein Comeback geben – in niedrigerer Konzentration und eingeschränkter Indikation. Dem Vernehmen nach stehen einige Hersteller kurz vor der Zulassung. Ein Sprecher des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) bestätigt: „Uns liegen derzeit insgesamt sechs Zulassungsanträge vor.“
Insgesamt sind die Hersteller überraschend spät dran, denn eigentlich kam der Rückruf nicht überraschend. Schon im Dezember 2011 hatte die Europäische Arzneimittelagentur (EMA) auf Antrag der französischen Arzneimittelbehörde ANSM eine Risikobewertung für alle MCP-Monopräparate durchgeführt. Im Januar 2012 wurden die Hersteller auf das Risikobewertungsverfahren aufmerksam gemacht und um Stellungnahme gebeten.
Im Juli 2013 hatten die Experten ihre Empfehlungen vorgelegt: Demnach sollte MCP maximal für einen Zeitraum von fünf Tagen verordnet werden. Chronische Indikationen sollten komplett gestrichen werden. Ende Oktober entschied die EMA, dass alle Lösungen, die mehr als 1mg/ml Wirkstoff enthalten, wegen der potenziellen Risiken außer Handel genommen werden sollten.
Die EU-Kommission folgte dieser Empfehlung im Dezember 2013 und entschied, dass die Zulassungen für MCP-haltige Arzneimittel ab einem bestimmten Grenzwert widerrufen werden müssen. Mit dem BfArM-Bescheid vom 15. April 2014 wurde der Beschluss aus Brüssel umgesetzt. Davon waren alle in Deutschland erhältlichen Tropfen betroffen, denn gängig waren die Wirkstoffkonzentrationen von 4 oder 5 mg/ml.
Kinder unter einem Jahr sollten MCP gar nicht erhalten; darüber hinaus solle der Wirkstoff in der Pädiatrie nur als Mittel der zweiten Wahl eingesetzt werden, so die EMA-Empfehlung. Als Höchstdosis wurden für Erwachsene und Kinder 0,5 mg/kg Körpergewicht in 24 Stunden festgelegt. Routinemäßig sollten Erwachsene 10 mg bis zu dreimal täglich erhalten, Kinder entsprechend 0,1 bis 0,15 mg/kg. Für intravenöse Arzneiformen liegt die Höchstdosis bei 5 mg/ml – zu geben über einen Zeitraum von bis mindestens drei Minuten –, für Suppositorien bei 20 mg.
Der Dopamin-Antagonist war zugelassen bei Motalitätsstörungen des oberen Magen-Darm-Traktes, Übelkeit, Brechreiz und Erbrechen unter anderem bei Migräne, Leber- und Nierenerkrankungen und Arzneimittelunverträglichkeiten sowie bei Chemotherapien. Laut Arzneiverordnungsreport wurden 2013 insgesamt 5,5 Millionen Packungen alleine auf Kassenrezept verordnet; dazu kommt entsprechend der Privatanteil.
Dieses weite Anwendungsfeld könnte deutlich kleiner werden. Denn dem Vernehmen nach soll es eine Indikationseinschränkung für MCP geben: Der Wirkstoff soll demnach künftig nur noch bei Übelkeit bei Migräne und Chemotherapie zugelassen werden.
Die Hersteller mussten aufgrund der Änderungen neue Zulassungen beim BfArM beantragen. Erste Schritte dazu hatten die Unternehmen bereits im April unternommen. Stada beispielsweise teilte damals mit, alle notwendigen Maßnahmen in die Wege geleitet zu haben. Die Konkurrenz hat vermutlich auch reagiert: Auch MCP-Tropfen von Abbott (Paspertin) und Dolorgiet (Gastronerton) sowie die Generika von 1A/Hexal/Sandoz, Ratiopharm/AbZ und Betapharm waren von dem Rückruf betroffen.
Der schnellste Weg zu einer Zulassung hätte in diesem Fall über das europäische Verfahren der gegenseitigen Anerkennung („mutual recognition procedure“) führen können. Dabei stützen sich die Hersteller auf bereits existierende Zulassungen aus anderen EU-Staaten. Doch dem Vernehmen nach gab es dabei Probleme. Theoretisch hätte das Verfahren nach 180 Tagen abgeschlossen sein müssen: Jeweils 90 Tage haben die Behörden der Referenzstaaten und in den Ländern, in denen die Zulassungen anerkannt werden sollen, für die Bewertung Zeit.
Referenzstaaten in diesem Fall sind Belgien, Frankreich, Griechenland, Großbritannien, Italien, Luxemburg, die Niederlande, Norwegen, Portugal, Slowenien und Spanien. Nach EMA-Informationen sind in diesen elf EU-Staaten derzeit Präparate mit der MCP-Konzentration 1mg/ml auf dem Markt.





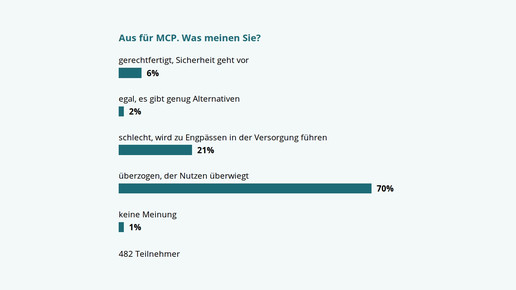















APOTHEKE ADHOC Debatte