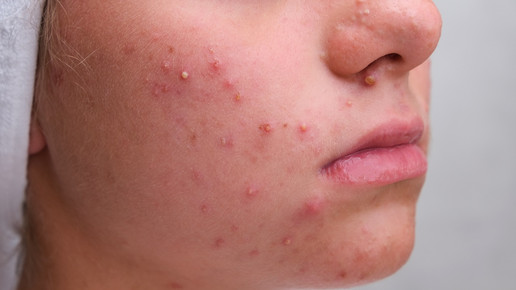
Akne: Premiere für topischen Androgenblocker
Die Europäische Arzneimittel-Agentur (EMA) hat eine positive Stellungnahme zu Winlevi (Clascoteron, Cassiopea) abgegeben. Erwachsene können die Creme auf der gesamten Haut anwenden, Jugendliche nur im Gesicht. Im April war der Antrag noch wegen Sicherheitsbedenken gescheitert.
Ende August hat der Ausschuss für Humanarzneimittel (CHMP) nach erneuter Prüfung eine positive Stellungnahme zu Winlevi abgegeben und die Zulassung zur Behandlung von Akne vulgaris empfohlen. Das Arzneimittel mit dem Wirkstoff Clascoteron soll bei Erwachsenen allgemein und bei Jugendlichen von 12 bis unter 18 Jahren ausschließlich im Gesicht angewendet werden. Die endgültige Entscheidung über die Marktzulassung trifft die EU-Kommission, die in der Regel dem Votum des CHMP folgt.
Erster Androgenrezeptor-Antagonisten bei Akne
Winlevi soll in der EU erstmals zur topischen Behandlung von Akne zugelassen werden. In den USA ist das Präparat bereits seit 2020 verfügbar. Die FDA stellte in einem Review von 2022 keine relevanten Sicherheitssignale fest, empfiehlt aber, bei Symptomen wie ungewöhnlicher Müdigkeit, Übelkeit oder Hautausschlägen ärztliche Hilfe aufzusuchen.
Das Arzneimittel wird als Creme mit einer Konzentration von 10 mg/g angewendet. Sein Wirkstoff Clascoteron gehört zu einer neuen Klasse von Androgenrezeptor-Antagonisten, die direkt in der Haut wirken. In vitro konnte gezeigt werden, dass Clascoteron die Wirkung von Androgenen in primären humanen Sebozyten hemmt und dadurch sowohl die Talgproduktion als auch die Freisetzung entzündlicher Mediatoren reduziert.
Erfolgreiche Phase-III-Studie
Die Wirksamkeit wurde in zwei Phase-III-Studien mit rund 1440 Patientinnen und Patienten untersucht, die die Creme über zwölf Wochen zweimal täglich im Gesicht anwendeten. Der Schweregrad der Akne wurde anhand des Investigator’s Global Assessment (IGA) beurteilt, einer fünfstufigen Skala von 0 bis 4. Ein Wert von 0 steht für klare Haut ohne Läsionen, 1 für fast klare Haut mit nur wenigen minimalen Läsionen, 2 für leichte Akne, 3 für eine moderate Ausprägung und 4 für schwere Akne mit zahlreichen entzündlichen Effloreszenzen.
Als Ansprechen galt in der Studie das Erreichen eines IGA-Scores von 0 oder 1 sowie eine Verbesserung um mindestens zwei Punkte gegenüber dem Im Gesamtkollektiv erreichten 19,5 Prozent der Behandelten dieses Ziel, verglichen mit 7,7 Prozent in der Placebogruppe, die lediglich das Vehikel ohne Wirkstoff erhielt. Bei moderater Akne lag die Erfolgsrate bei 18,9 gegenüber 6,6 Prozent, bei schwerer Akne bei 10,4 gegenüber 1,8 Prozent. Zu den häufigsten Nebenwirkungen zählten lokale Hautreaktionen wie Erythem, Trockenheit, Schuppung, Juckreiz und ein stechendes oder brennendes Gefühl.
Sicherheitsbedenken ausgeräumt
Zuvor hatte die EMA den Antrag am 25. April 2025 abgelehnt. Grund waren Sicherheitsbedenken für Jugendliche, da eine systemische Aufnahme von Clascoteron theoretisch zu einer Suppression der Hypothalamus-Hypophysen-Nebennierenrinden-Achse führen könnte. Diese sogenannte HPA-Achsen-Suppression kann Wachstum und sexuelle Reifung beeinträchtigen. Die zunächst vorgelegten Daten und Maßnahmen zur Risikominimierung reichten nicht aus, um die Zulassung in dieser Altersgruppe zu empfehlen.
Im anschließenden Re-examination-Verfahren schlug Hersteller Cassiopea zusätzliche Maßnahmen vor, darunter eine Dosisbegrenzung, die Anwendung ausschließlich im Gesicht, engmaschiges Monitoring sowie Schulungsmaterial für Ärztinnen, Ärzte und Fachpersonal. Außerdem darf Winlevi nur von in der Aknetherapie erfahrenen Ärztinnen und Ärzten verordnet werden, was auch Praxen und Apotheken eine verstärkte Beratungspflicht auferlegt. Unter diesen Auflagen bewertete der CHMP das Nutzen-Risiko-Verhältnis als positiv.










APOTHEKE ADHOC Debatte