Ximluci: Stada bringt Ranibizumab-Biosimilar
Stada und die Xbrane Biopharma bringen mit Ximluci ein Biosimilar zu Lucentis auf den deutschen Markt. Ophthalmologen sollen so bei Ranibizumab eine wirtschaftliche Alternative bekommen. Die Auslieferung ist bereits angelaufen.
In Deutschland leiden aktuell etwa 7,4 Millionen Menschen an einer Altersabhängigen Makuladegeneration (AMD), wovon circa 10 bis 15 Prozent von einer neovaskulären altersabhängigen Makuladegeneration (nAMD) betroffen sind. Expert:innen vermuten, dass die Zahl der Betroffenen in Zukunft aufgrund der generellen demographischen Entwicklung in Deutschland voraussichtlich weiter zunehmen wird. AMD-Betroffene haben es durch die bedingte Beeinträchtigung des Sehvermögens im Alltag oft schwer und die Lebensqualität leidet.
Symptome der AMD
Diechronische Erkrankung betrifft meist beide Augen und liegt einer Störung des Stoffwechsels zugrunde. Sie entsteht an der sogenannten Makula der Stelle der Netzhaut, die für das scharfe Sehen besonders wichtig ist. Regelrechte Sehbehinderungen treten häufig erst bei einer fortgeschrittenen AMD auf. Hier sind zwei Formen zu unterscheiden:
feuchte AMD, auch neovaskuläre AMD
- verzerrtes Sehen, Buchstaben verschwimmen
- schwarze Punkte vor dem Auge
- Schatten im Sichtsfeld
trockene AMD
- kann im weiteren Verlauf in die feuchte Form übergehen
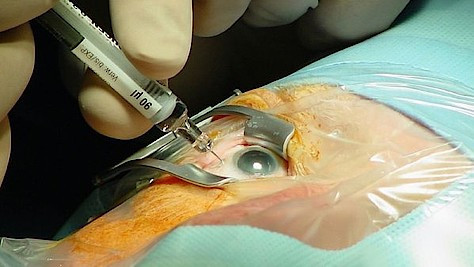
Die Erkrankung ist nicht heilbar, aber das Fortschreiten kann oft mit Medikamenten zum Stillstand gebracht werden. Ximluci mit dem Wirkstoff Ranibizumab kann nun als weitere Therapieoption genutzt werden, um Symptome der Betroffenen zu lindern.
„Wir freuen uns sehr, deutschen Augenärzten und deren Patienten mit Ximluci ab sofort eine weitere Therapieoption zur Behandlung neovaskulärer Erkrankungen der Netzhaut anbieten zu können“, so Dr. Martin Spatz, Leiter des Specialty-Geschäfts von Stada in Deutschland. Die Auslieferung ist in einigen europäischen Ländern wie Deutschland bereits angelaufen, während in anderen derzeit die Markteinführung vorbereitet wird. „Mit unserem Ranibizumab-Biosimilar ermöglichen wir gemeinsam mit unserem Partner Xbrane noch mehr Patient:innen den Zugang zu biologischen Behandlungsalternativen und tragen somit zur Entlastung der Gesundheitssysteme bei.“
Zugelassen für weitere Indikationen
Ximluci wird als Durchstechflasche à 2,3 mg/0,23 ml für die intravitreale Injektion in Deutschland angeboten. Das Medikament ist in der EU und in Großbritannien nicht nur für die Behandlung der nAMD zugelassen, sondern auch zur Behandlung der proliferativen diabetischen Retinopathie (PDR) sowie zur Behandlung einer Visusbeeinträchtigung infolge eines diabetischen Makulaödems (DMÖ), eines retinalen Venenverschlusses (RVV) und einer chorioidalen Neovaskularisation (CNV) bei Erwachsenen.
Die EU-Zulassung für Ximluci basiert auf umfassenden analytischen Vergleichen mit dem Referenzprodukt und einer umfangreichen klinischen Phase-III-Studie, welche eine gleichwertige Wirksamkeit und ein vergleichbares Sicherheits- und Immunogenitätsprofil von Ximluci im mit dem Referenzprodukt ergab.
















APOTHEKE ADHOC Debatte