Rx-Werbung: FDA rügt Kim Kardashian
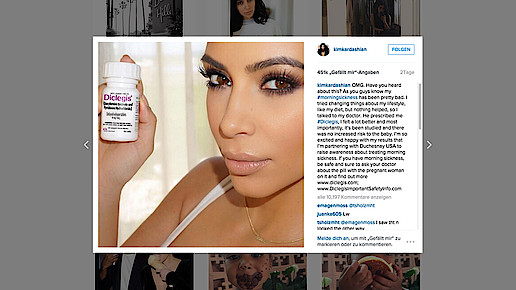
Kim Kardashian hat Post von der US-Arzneimittelbehörde FDA bekommen. In einem Posting auf der Social-Media-Plattform Instagram hatte die schwangere Schönheit eine Dose des verschreibungspflichtigen Präparats Diclegis (Doxylamin, Pyridoxin) in die Kamera gehalten und von dem Produkt geschwärmt. Risiken gebe es keine. Die FDA wies die Reality-Queen und Hersteller Duchesnay nun zurecht: Der Beitrag sei irreführend und verstoße gegen das Arzneimittelrecht. Das Verschweigen der Risiken gefährde die öffentliche Gesundheit.
Kardashian ist im sechsten Monat schwanger. In ihrem Instagram-Posting Mitte Juli schrieb sie an ihre knapp 40 Millionen Follower: „Wie ihr ja wisst, leide ich ziemlich unter morgendlicher Übelkeit.“ Sie habe alles versucht, sie habe ihren Lebensstil und ihre Ernährung geändert, aber nichts habe geholfen. So hätte sie schließlich mit ihrem Arzt gesprochen: „Er hat mir #Diclegis verordnet. Jetzt geht es mir viel besser. Aber noch wichtiger: Es gibt kein Risiko für das Baby.“
Sie sei so glücklich über die erfolgreiche Therapie, dass sie mit Hersteller Duchesnay eine Kooperation eingegangen sei. Sie wolle Aufmerksamkeit und Bewusstsein für die Behandlung von morgendlicher Übelkeit erzeugen. „Wenn Ihr darunter leidet, geht auf Nummer sicher und fragt Euren Arzt nach der Pille mit der schwangeren Frau darauf.“ Darüber hinaus verwies sie auf die Internetseite des Herstellers.
Dafür hat dieser hat nun eine Verwarnung vom zur FDA gehörenden Office of Prescription Drug Promotion (OPDP) kassiert, das für die Überwachung der Arzneimittelinformation zuständig ist: Kardashian hätte in ihrem Posting explizit auf Nebenwirkungen und Kontraindikationen hinweisen müssen. Zu Diclegis gebe es beispielsweise keine Studien an Frauen mit schwangerschaftsbedingter Übelkeit. Da Kardashian aber sowohl die Studienlage als auch die Risiken verschwieg, liege ein Verstoß gegen das Arzneimittelgesetz vor. Insbesondere vor dem Hintergrund, dass der Hersteller erst im November 2013 wegen lückenhafter Patienteninformationen verwarnt wurde, mache sich die FDA Sorgen. Man befürchte, dass Duchesnay die Strategie der Desinformation fortsetzen werde.
Daher fordert die Behörde eine schriftliche Stellungnahme des Herstellers, in der Auskunft über geplante Marketingaktivitäten gegeben werden soll – vor allem, ob ähnliche Aktionen für die Zukunft vorgesehen sind. Wegen der Schwere der Verstöße solle Duchesnay einen umfassenden Aktionsplan vorlegen, anhand dessen die bislang verbreiteten Fehlinformationen richtiggestellt werden sollen. Der Hersteller soll sicherstellen, dass alle Patienten, die die Werbeinformationen erhalten haben, auch über die Korrekturen informiert werden. Dazu seien die gleichen Kanäle zu benutzen.
Sollte Duchesnay den Forderungen der OPDP nicht Folge leisten, müsse der Hersteller mit rechtlichen Konsequenzen bis hin zu einem unangekündigten Entzug der Zulassung für Diclegis rechnen.
Ob Kardashian im Rahmen ihrer Kooperation mit Duchesnay bald ein weiteres Posting zu Diclegis absetzen wird, bleibt abzuwarten. Die Ehefrau von Rapper Kanye West hat sowohl ihre erste als auch die aktuelle Schwangerschaft von Beginn an öffentlichkeitswirksam vermarktet. Seit sie ihr zweites Kind im Mai angekündigt hat, berichtete sie von morgendlicher Übelkeit. Die Instagram-Follower haben das breit diskutiert.
Diclegis hat eine bewegte Geschichte. 1956 wurde die Wirkstoffkombination unter dem Namen Bendectin in den USA zugelassen. 1983 verlor das Präparat seine Verkehrsfähigkeit: Zahlreiche Klagen gegen den Hersteller machten das Mittel für Fehlbildungen an den Neugeborenen verantwortlich.
Obwohl die Verfahren keine große Aussicht auf Erfolg hatten, reichten sie doch, um den Hersteller an den Rand seiner Existenz zu treiben. Auch die FDA konnte den Verdacht nie bestätigen. Das Unternehmen zog das Präparat letztlich freiwillig vom Markt zurück.
In den folgenden 30 Jahren gab es kein neues Mittel für die Indikation. Die Zahl der Krankenhauseinlieferungen wegen Übelkeit während der Schwangerschaft verdoppelte sich in den USA in dieser Zeit. In anderen Ländern blieb Doxylamin/Pyridoxin verkehrsfähig. Erst 2013 erhielt die Wirkstoffkombination wieder eine FDA-Zulassung und wurde unter dem Namen Diclegis eingeführt.



















APOTHEKE ADHOC Debatte