Puren: Verkehrte Welt
Arzneimittelpackungen sind in ihrer Schlichtheit eine Kunst, die es zu beherrschen gilt. Das musste auch der Generikahersteller Puren erfahren: Beim Kontrazeptivum Aurodes-EE ging es bei den Dosierangaben etwas durcheinander. Einen Rückruf gibt es nicht, aber eine Klarstellung.
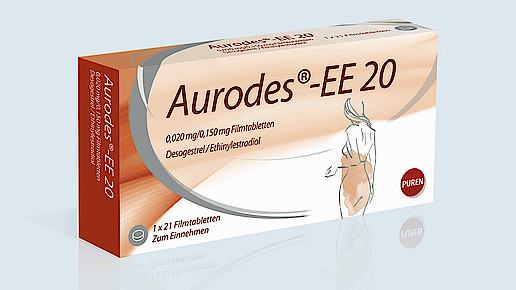
Aurodes-EE ist ein Kontrazeptivum, das EE steht für Ethinylestradiol. Außerdem enthalten ist Desogestrel, was aber im Namen nicht wiederzufinden ist. Aurodes-EE 20 enthält 20 µg Etginylestradiol sowie 150 µg Desogestrel. Bei Aurodes-EE 30 sind bei gleichem Gehalt an Desogestrel 10 µg Ethinylestradiol mehr zu finden.
Auf der Verpackung wird entsprechend unter dem Namen auf die Dosierung hingewiesen: „0,150 mg/0,030 mg Filmtabletten“, heißt es bei Aurodes-EE 30. Darunter stehen die Wirkstoffe: „Desogestrel/Ethinylestradiol“. Beim schwächer dosierten Produkte sind die Wirkstoffe in derselben Reihenfolge angegeben. Bei der Dosierung heißt es aber: „0,020 mg/0,150 mg Filmtabletten“.
Das ist zumindest missverständlich, denn die 0,020 mg beziehen sich nicht auf Desogestrel, sondern auf Ethinylestradiol. Aus einer Apotheke erhielt die Arzneimittelkommission der Deutschen Apotheker (AMK) einen Hinweis, dass da etwas nicht stimmen könne.
Puren stellt nun klar: „Die Reihenfolge der Angabe der Wirkstoffe auf Blister, Blisteretui, Faltschachtel und Gebrauchsinformation entsprach nicht der Reihenfolge der Stärkenangabe in der offiziellen Bezeichnung des Arzneimittels.“ Der Hersteller aus München hat beim BfArM eine Korrektur beantragt, um zukünftig potentielle Missverständnisse zu vermeiden. Ein Rückruf der betroffenen Packungen sei nicht vorgesehen. Die AMK bittet die Apotheken, im Rahmen der Abgabe und Beratung auf diesen Aspekt in angemessener Weise hinzuweisen.
Im Januar hatte sich Reckitt Benckiser (RB) für eine Panne auf der Verpackung von Nurofen entschuldigen müssen. Laut Hersteller wurde das minimale Körpergewicht des Kindes, ab dem die Fieber- und Schmerzsäfte angewendet werden dürfen, von 8 auf 7 Kilogramm verringert. Die Dosierungstabelle auf dem Flaschenetikett sowie die Angaben auf dem Karton und in der Gebrauchsinformation wurden zwar korrekt angepasst. Allerdings wurde versäumt, die Angabe zum Körpergewicht auf dem Flaschenetikett zu ändern.
Auch hier hatten Apotheken die AMK auf den Fehler aufmerksam gemacht. Ein Rückruf wurde ebenfalls nicht veranlasst. Nur wenn das Risiko der Fehlanwendung besteht, müssen mitunter ganze Chargen zurück.
























APOTHEKE ADHOC Debatte