BfArM bastelt an Kombi-Liste
Den 21. August können sich Apotheker schon einmal im Kalender markieren: Dann kommt die neue Liste des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) zu Arzneimitteln, die wegen mutmaßlich gefälschter Bioäquivalenzstudien nicht mehr verkehrsfähig sind. Zwar hat die Behörde die Aktualisierung mit Vorlauf angekündigt – doch welche Arzneimittel letztlich betroffen sind, lässt sich derzeit noch nicht sagen.
Die Europäische Arzneimittelagentur (EMA) hatte insgesamt mehr als 1000 Zulassungen geprüft. Der Ausschuss für Humanarzneimittel (CHM) empfahl im Januar für rund 700 Medikamente das Ruhen der Zulassung. Rund 50 deutsche Arzneimittel waren betroffen. Im folgenden Anhörungsverfahren konnte lediglich ein Hersteller aus Osteuropa die Zweifel aus der Welt schaffen und wurde von der Liste gestrichen. Die CHMP-Liste wurde gestern von der EU-Kommission abgenickt.
Das bedeutet laut BfArM, dass die Arzneimittel vom 21. August an nicht mehr verkehrsfähig sind. Die Mitgliedstaaten müssen den Beschluss nun umsetzen. Das BfArM hat angekündigt, den betroffenen Unternehmen von diesem Datum an per Bescheid mitzuteilen, dass das Ruhen der Zulassung angeordnet wurde.
Welche Arzneimittel konkret betroffen sein werden, ist derzeit noch nicht absehbar. Das BfArM hatte bei der Überprüfung Studien aus den Jahren 2008 bis 2014 berücksichtigt und Anfang Dezember 80 Arzneimittel für nicht verkehrsfähig erklärt. Der CHMP hatte zusätzlich Studien aus den Jahren 2004 bis 2007 einbezogen. Daher sind weitere Arzneimittel betroffen: Alendronsäure von Accord Healthcare, Ciprofloxacin und Venlafaxin von Fair-Med, Trimetazidin/HCT von Lupin und Escitalopram 5 mg von Micro Labs.
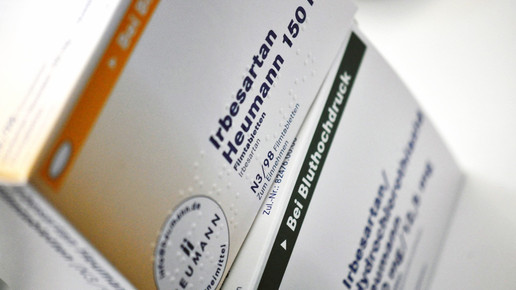
Auf der europäischen Liste stehen jedoch auch Präparate, die in Deutschland schon wieder verkehrsfähig sind. Heumann beispielsweise stand ursprünglich mit vier Präparaten auf der BfArM-Liste: Candesartan/HCT, Irbesartan, Irbesartan/HCT und Venlafaxin. Inzwischen wurde die Ruhensanordnung für alle wieder aufgehoben. Doch der CHMP hat Irbesartan und Irbesartan/HCT erneut gelistet.
Auch Panacea wird mit seinem Tacrolimus-Präparat Tacpan wieder aufgeführt, und zwar in allen Wirkstärken. Von der BfArM-Liste waren 0,5 und 1 mg bereits gestrichen, gegen die Ruhensanordnung für Tacpan 5 mg hatte der Hersteller Widerspruch eingelegt – mit aufschiebender Wirkung.
Ähnlich ist es Hormosan ergangen: Levetiracetam wurde zwar bereits von der BfArM-Liste gestrichen, aber Cefpodoxim wird noch geführt. Hormosan hat Widerspruch eingelegt, damit dürfen derzeit beide Hormosan-Präparate vertrieben werden. Auf der europäischen Liste ist Cefpodoxim wieder aufgeführt.
Bereits erfolgreich Widerspruch eingereicht hatten auch Fair-Med für Irbesartan, Irbesartan/HCT und Valsartan/HCT, Mylan dura für Repaglinid und Rizatriptan und Panacra für Tacpan 5 mg – alle sind nun wieder gelistet.
Das BfArM ist nun damit beschäftigt, die beiden Listen abzugleichen und bis Mitte August zusammenzufügen – in eine für Deutschland gültige Form. Liegen der Behörde bereits Bioäquivalenzstudien vor, etwa aus den früheren Verfahren, oder handelt es sich um dringend benötigte Arzneimittel, kann die Ruhensanordnung der EU-Kommission aufgehoben werden. Erschwert wird das womöglich dadurch, dass die CHMP – anders als das BfArM – keine Zulassungsnummern aufführt. Hersteller haben aber meist verschiedene Zulassungen für ein Präparat.
Anders sieht es für die Arzneimittel aus, bei denen die Hersteller Widerspruch gegen die Ruhensanordnung des BfArM eingelegt hatten und die daher noch vertrieben werden durften: Denn gegen den Beschluss der EU-Kommission können die Unternehmen nur klagen. Anders als der Widerspruch gegen die früheren Bescheide hat diese dem BfArM zufolge aber keine aufschiebende Wirkung. Das bedeutet, dass diese Präparate – wenn sie auch auf der neuen Liste des BfArM stehen – nicht mehr verkehrsfähig sind.
Sobald das BfArM die Bescheide verschickt hat, soll auch die eigene Liste aktualisiert und um die neuen Ruhensanordnungen ergänzt werden. Bis dahin bleibt die aktuelle Liste gültig, die zuletzt Anfang Mai überarbeitet worden war.
Um ein Chaos wie bei der Veröffentlichung dieser Liste im Dezember zu vermeiden, hat das BfArM die ABDA und die Arzneimittelkommission der deutschen Ärzteschaft (AKDÄ) bereits über dieses weitere Vorgehen informiert.
Anlass für die Anordnung der Überwachungsbehörden waren mutmaßlich gefälschte Bioäquivalenzstudien des indischen Dienstleisters GVK Biosciences. Bei einer Inspektion des Unternehmens durch die französische Arzneimittelbehörde ANSM waren laut EMA erhebliche Mängel bei der Studiendurchführung und der Datenvalidität festgestellt worden. In allen neun untersuchten Studien sollen Elektrokardiogramme gefälscht worden sein.














































APOTHEKE ADHOC Debatte