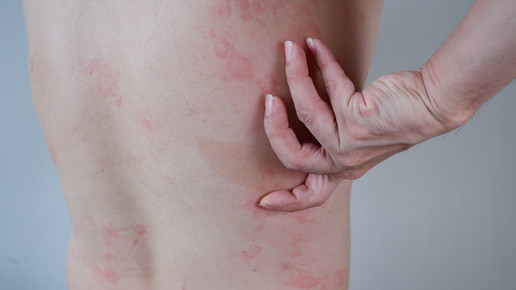
Omalizumab-Autoinjektor: Neue 300 mg-Dosis zugelassen
Bereits im November wurde der neue Autoinjektor Xolair mit einer 300 mg-Dosis für die Applikation von Omalizumab zugelassen. Die für die chronische spontane Urtikaria (csU) empfohlene Dosierung kann nun mit nur einer Injektion alle vier Wochen verabreicht werden. Novartis rechnet mit einer Marktverfügbarkeit ab Herbst 2024.
Seit 2014 ist Omalizumab als Zusatztherapie für die Behandlung von csU zugelassen, wenn die Patient:innen ab zwölf Jahren nicht ausreichend auf H1-Antihistaminika ansprachen. Seit 2018 ist auch die Selbstapplikation in Form einer 150 mg-Spritze möglich. Seit November ist nun ein neuer Autoinjektor mit 300 mg Injektionslösung im Fertigpen für die Selbstapplikation von Omalizumab zugelassen.
Ausschlaggebend waren die positiven Ergebnisse einer Bioäquivalenzstudie mit der 300mg-Dosis. In dieser konnte die Wirksamkeit von nur einer Spritze äquivalent zur Verabreichung von 2 x 150 mg Omalizumab bestätigt werden. Das erleichtert die Therapie für Betroffene. Denn: Die empfohlene Dosis von 300 mg, die alle vier Wochen verabreicht wird, kann fortan mit nur einer Injektion statt der üblichen zwei erreicht werden. „Für einen optimierten Einsatz von Omalizumab im Klinikalltag führen wir zudem eine neue Fertigspritze (300 mg Injektionslösung in einer Fertigspritze) ein“, so Novartis.
Das Wichtigste zu Xolair
Omalizumab ist ein rekombinanter, aus DNA abgeleiteter, humanisierter, monoklonaler Antikörper und bindet selektiv an das menschliche Immunglobulin E (IgE). Der Arzneistoff inaktiviert das menschliche IgE und verhindert dessen Bindung an seinen Rezeptor. Dadurch wird ein entscheidender Schritt in der allergischen Kaskade unterbunden. Xolair enthält Novartis zufolge den einzigen zugelassen Antikörper, der gegen IgE gerichtet ist. Durch die Reduzierung von freiem IgE, der Herabregulierung hochaffiner IgE-Rezeptoren und der Begrenzung der Mastzellendegranulation minimiert Omalizumab die Freisetzung von Mediatoren in der allergischen Entzündungskaskade.
Seit der Zulassung von Xolair bei allergischem Asthma im Jahr 2003 wurden in den USA ungefähr 460.000 Patienten mit dem Medikament behandelt. Die ärztliche Erfahrung in Europa mit Xolair beträgt laut Novartis 13 Jahre und etwa eine Million Patientenjahre. Die Anwendung bei allergischem Asthma und CIU wird durch ein solides klinisches Entwicklungsprogramm unterstützt, das acht Phase-III-Studien umfasst. Wirksamkeit und Sicherheit des Arzneimittels wurden in einer Vielzahl von randomisierten klinischen Studien belegt.
Anaphylaktische Reaktionen während der Studien mit einer Häufigkeit von 1/10.000 bis kleiner 1/1000 dokumentiert. Berichte nach der Markteinführung beziffern die Häufigkeit auf etwa 0,2 Prozent. Unabhängige klinische Studien mit Patienten mit allergischem Asthma und CIU unter Xolair-Behandlung legen nahe, dass eine Selbstverabreichung bei angemessener Schulung und Überwachung möglich ist. Xolair wurde bisher alle zwei oder vier Wochen injiziert.


















APOTHEKE ADHOC Debatte