Die Sanofi-Tochter Winthrop/Zentiva ruft eine Charge Amlodipin Winthrop 5 mg, 100 Tabletten zurück. Grund ist eine Untermischung mit Blistern eines anderen Produktes.
Der Fehler war im Ausland aufgefallen. Da eine Untermischung auch von Packungen, die in Deutschland vertrieben werden, nicht ausgeschlossen werden kann, ruft der Hersteller die Charge 3040116 zurück.
Einem Großhändler in Polen war aufgefallen, dass in einem Karton mit Neurol (Alprazolam) zwei Schachteln mit der Aufschrift Atram (Carvedilol) enthalten waren, die aber wiederum Neurol-Blister enthielten. Nach internen Untersuchungen wurde beschlossen, vorsichtshalber alle im selben Zeitraum am Standort in Prag produzierten Präparate zurückzurufen.
Apotheken sollen ihre Lagerbestände kontrollieren und betroffene Packungen über den pharmazeutischen Großhandel zur Gutschrift zurückschicken. Direktbezieher senden die Ware ausreichend frankiert an:
Sanofi-Aventis Deutschland GmbH
Distribution Platform Frankfurt
Retourenstelle Gebäude H590
Industriepark Hoechst
65927 Frankfurt am Main
Aus den USA stammen Hinweise über Qualitätsmängel bei den Chlorhexidin-haltigen Reinigungstüchern des Herstellers Sage. Zunächst hatte es eine Reklamation eines anderen Produkts gegeben, eine Reserveprobe wurde positiv auf eine Verseuchung mit dem Bakterium Burkholderia cepacia getestet. Nach näheren Untersuchungen kam das Unternehmen zu dem Schluss, dass die Ursache auf das Reinigungssystem zweier Produktionslinien zurückzuführen ist. An einer dieser beiden Produktionslinien wird Chlorhexidingluconat Sage 20 mg/ml, 6 imprägnierte Tücher (PZN 10398334), hergestellt.
Obwohl alle weiteren getesteten Reserveproben nicht verunreinigt waren, werden alle auf diesen beiden Linien hergestellten Produkte vorsichtshalber vom Markt genommen. Die Verwendung der infizierten Tücher könne bei immungeschwächten Patienten und anderen Patientengruppen ernsthafte Nebenwirkungen verursachen, so der Hersteller. Diese Nebenwirkungen könnten von relativ harmlosen Reaktionen wie Hautausschlag oder anderen Hautreizungen bis hin zu potenziell schwerwiegenden Erkrankungen wie Blutinfektion oder Infektionen der Luftwege stark variieren.
Die infizierten Tücher zeigen laut Unternehmen eine leicht bräunliche Verfärbung und haben einen starken Geruch. Augenscheinlich nicht infizierte Tücher könnten aber ebenfalls infiziert sein. Betroffene Packungen sollen zur Gutschrift inklusive Portokosten zurückgeschickt werden an:
Geodis Logistics Netherlands B.V.
p/a Columbusweg 16, Office 2
5928 LC Venlo, TP 9039
Niederlande
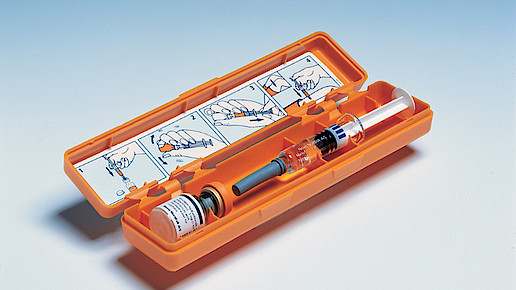
Mit einer Woche Verspätung ruft der Reimporteur Eurim drei Chargen des Glucagen Hypokit (Glucagon) zurück: FS6X535, FS6X718 und FS6X874. Der Originalhersteller Novo Nordisk hatte mehrere Chargen des Arzneimittels bis auf Patientenebene zurückgerufen, weil sich in einer Untersuchung bei diesen Chargen in 0,006 Prozent der Fälle die Nadel von der Fertigspritze gelöst hatte. Da das GlucaGen HypoKit zur Behandlung schwerer Hypoglykämien bei insulinpflichtigen Diabetikern eingesetzt wird, kann eine nicht verwendbare Spritze im Anwendungsfall schwerwiegende Folgen haben.
Eurim bittet die Apotheken um Prüfung ihrer Bestände und ungekühlte Rücksendung an:
EurimPharm Arzneimittel GmbH
EurimPark 8
83416 Saaldorf-Surheim
Novo Nordisk hat ein Informationsschreiben für Patienten veröffentlicht, das von der BfArM-Seite heruntergeladen werden: www.bfarm.de --> Arzneimittel -> Pharmakovigilanz --> Risikoinformationen --> Rote-Hand-Briefe und Informationsbriefe.

























APOTHEKE ADHOC Debatte