EuGH stärkt Reimporteure Patrick Hollstein, 29.11.2016 13:28 Uhr
Reimportierte Arzneimittel müssen eine Zulassung haben – aber gilt eine vergleichbare Pflicht auch für Medizinprodukte aus dem Ausland? Nein, entschied jetzt der Europäische Gerichtshof (EuGH) in zwei Verfahren. Die sogenannte Konformitätsbewertung muss nicht erneut durchgeführt werden. Anders als bei Medikamenten muss der Hersteller auch nicht vorab informiert werden.
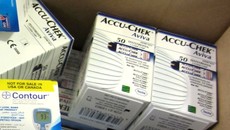
In einem Verfahren ging es um einen sterilen Wundverband von Lohmann & Rauscher, im anderen um Blutzuckermessstreifen der Marke Accu-Chek von Roche. In beiden Fällen hatten die Reimporteure Bios Medical beziehungsweise Servoprax Aufkleber auf die Originalpackung mit PZN und den jeweiligen Firmenangaben aufgebracht. Im Fall der Teststreifen war zusätzlich eine deutsche Packungsbeilage beigefügt worden; in dieser war allerdings – analog zum Referenzprodukt – nur die Messeinheit mmol/l angegeben. Im Unterschied dazu hielt der deutsche Beipackzettel von Roche zusätzlich die Angabe mg/dl bereit.
Die Originalanbieter klagten: Aus ihrer Sicht hätten die Importeure wegen der Veränderung einer Packung mit CE-Kennzeichen eine ergänzende Konformitätsbewertung durchführen lassen müssen. Den Streit zwischen Roche und Servoprax legte der Bundesgerichtshof (BGH) in Luxemburg vor; zuvor hatte das Oberlandesgericht (OLG) Frankfurt dem Konzern Recht gegeben. Der Streit um die Wundverbände kam vom OLG Düsseldorf zum EuGH.
Die beiden vorlegenden Gerichte sahen jeweils eine andere EU-Richtlinie tangiert: Im Kern ging es um die Frage, ob Reimporteure als Hersteller anzusehen sind und daher zur Konformitätsbewertung verpflichtet sind. Das OLG bezog sich auf die Medizinprodukte-Richtlinie, der BGH auf die Richtlinie zu In-vitro-Diagnostika.
In beiden Fällen kam der EuGH zu dem Schluss, dass die Änderungen der Verpackung als so geringfügig anzusehen sind, dass Reimporteure nicht denselben Pflichten wie Hersteller unterliegen und dass damit keine erneute Konformitätsbewertung durchzuführen ist. Denn Reimporteure bringen Produkte laut EuGH nicht „in eigenem Namen“ in den Verkehr. Sollten tatsächlich Sicherheitsbedenken auftreten, obliege es den Mitgliedstaaten, Schutzmaßnahmen zu ergreifen.
Im Fall von Accu-Chek stellten die Richter außerdem klar, die Messeinheit mmol/l genüge und dass auch die Übersetzung des Beipackzettels nicht zu beanstanden sei. Anders als bei Arzneimitteln gibt es laut EuGH bei Medizinprodukten und Diagnostika auch keine Verpflichtung für Reimporteure, den Originalhersteller vorab zu unterrichten. Die CE-Kennzeichnung gewährt dem Hersteller kein ausschließliches Recht, das mit dem Ausschließlichkeitsrecht des Markeninhabers vergleichbar wäre.
Mit der Konformitätserklärung bestätigt der Hersteller gegenüber einer „benannten Stelle“, dass sein Produkt alle Sicherheitsanforderungen erfüllt. Dabei müssen neben der Produktbeschreibung auch Angaben zum Hersteller und zu den jeweiligen Normen und technischen Spezifikationen gemacht werden. Eine Genehmigung ist dabei nicht erforderlich. Mit zwei neuen EU-Verordnungen sollen nach dem PIP-Skandal die Sicherheitstandards für Medizinprodukte und In-vitro-Diagnostika aber angehoben werden.