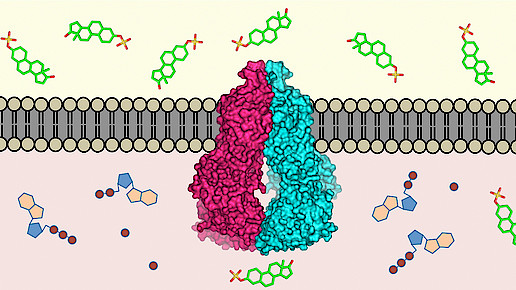
Gifttransporter: 3D-Struktur entschlüsselt
Körpereigene Transportproteine schleusen xenobiotische Substanzen aus dem Organismus und dienen damit als Schutzmechanismus. Bei einer Arzneimitteltherapie hingegen ist dieser Effekt unerwünscht, denn so stehen bestimmte Wirkstoffmoleküle nicht zur Wirkung bereit. Wissenschaftler der Eidgenössischen Technischen Hochschule Zürich (ETH) und der Universität Basel haben nun die dreidimensionale Struktur des Transportproteins ABCG2 aufgeklärt. Künftig könnten dadurch neue Arzneimittel entwickelt werden, die nicht mehr von von der Zelle als Giftstoffe angesehen werden. Die Forschungsergebnisse wurden im Fachjournal „Nature“ veröffentlicht.
In der Zellmembran sitzen Transportpumpen, die für die Zelle bedenkliche Stoffe erkennen und diese nach außen transportieren. Dieser Mechanismus verhindert beispielsweise, dass schädliche Substanzen ins Blutsystem gelangen oder die Blut-Hirn-Schranke überwinden. Aber auch in den Milchdrüsen und in der Plazenta spielen sie eine bedeutende Rolle, da sie den Übergang von giftigen Stoffen in die Muttermilch oder in den Blutkreislauf des Fötus vermeiden.
Die molekulare Verknüpfung dieses Proteins konnte nun durch die Gruppe um Professor Dr. Kaspar Locher, Experte für Molekulare Membranbiologie an der ETH Zürich, in Zusammenarbeit mit Professor Dr. Henning Stahlberg vom Biozentrum der Universität Basel bestimmt werden. Es ist die erste solche Struktur für einen humanen multispezifischen Arzneistofftransporter („multi-drug transporter“), die nun bekannt ist.
„Das Protein ABCG2 erkennt und transportiert mindestens 200 bekannte Stoffe“, erklärt Locher, der auch Leiter der Studie ist. Sowohl endogene Substanzen wie Harnsäure und Bilirubin etc. als auch exogene Stoffe wie Alkaloide aus der Nahrung werden vom Transporter identifiziert und ausgeschleust. Allerdings kann diese grundlegende Funktion auch zum Nachteil werden, denn bestimmte Arzneistoffe können dann nicht im Zellinneren wirken. „Bei der Entwicklung von Medikamenten muss daher immer untersucht werden, ob sie von Transportproteinen wie ABCG2 erkannt werden“, sagt Locher.
Die Entschlüsselung der Struktur gelang mittels Kryo-Elektronenmikroskopie, einer Methode, die zur dreidimensionalen Darstellung von Zellstrukturen eingesetzt wird. In diesem Rahmen wurde das Protein mit Hilfe von stabilisierenden Antikörpern immobilisiert. „Wir haben in der letzten Zeit intensiv daran gearbeitet, unsere Elektronenmikroskope in deren Auflösungsvermögen zu optimieren und gleichzeitig weitgehend zu automatisieren. So haben wir eine unglaublich schnelle Analysepipeline geschaffen“, sagt Stahlberg.
Medikamente, die oral verabreicht werden, müssen die Darmwand durchdringen, und solche, die im Gehirn wirken sollen, müssen die Blut-Hirn-Schranke passieren. Die ist nur möglich, wenn ABCG2 sie nicht erkennt. Es ist bekannt, dass einige Chemotherapeutika diesen Effluxtransporter erkennen können. Zudem sind bestimmte Tumorzellen in der Lage, die Genexpression zu steigern und somit die Anzahl der ABCG2-Proteine in der Zellmembran zu erhöhen. Dadurch werden die zytostatischen Substanzen zurück in den Außenraum transportiert, die Zellen sind resistent.
Die Forscher könnten künftig mit Hilfe des Molecular Modelling am Computer simulieren, ob ABCG2 neue Arzneimittel erkennen kann. Außerdem wäre es möglich, dass bessere Antikörper für die Diagnose medikamentenresistenter Krebszellen erforscht werden. Auch wäre die Entwicklung von ABCG2-Inhibitoren denkbar, denn solche Arzneistoffe könnten die Resistenzen gegenüber Chemotherapeutika aufheben. „Die Beiträge unserer Forschung für die Medizin und insbesondere die Krebsmedizin sind jedoch längerfristig zu sehen. Wir liefern in erster Linie die Grundlage“, so Locher.

















APOTHEKE ADHOC Debatte