Cannabisextrakt: Gericht fordert Arzneimittelzulassung
Vollspektrum-Extrakte auf Basis von Cannabis sind nach wie vor Rezepturarzneimittel und müssen dementsprechend abgerechnet werden. Das Oberlandesgericht (OLG) Düsseldorf hat kürzlich im Eilverfahren die Verkehrsfähigkeit der Präparate infrage gestellt und eine Arzneimittelzulassung gefordert. Was würde sich für Apotheker und PTA ändern, wenn die öligen Tropfen in Form eines Fertigarzneimittels auf dem Markt wären?
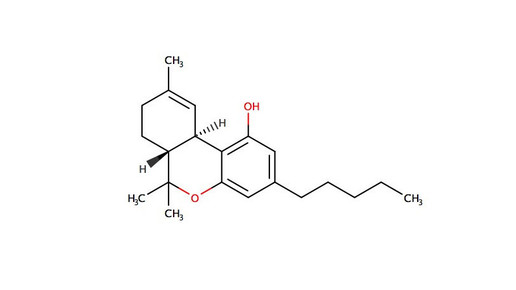
Im aktuellen Fall hatte der „Schutzverband gegen Unwesen in der Wirtschaft” gegen den Cannabis-Hersteller Tilray geklagt, der Apotheken mit den beiden standardisierten Cannabisextrakten „THC25“ und „THC10:CBD10“ versorgt. Bei den Produkten handelt es sich um sogenannte Vollspektrum-Extrakte, die neben den beiden Hauptwirkstoffen Tetrahydrocannabinol (THC) und Cannabidiol (CBD) auch alle weiteren Wirkstoffe der Cannabisblüte, wie beispielsweise Terpene, enthalten. Das Produkt „THC25“ weist einen THC-Gehalt von 25 mg/ml auf. Der CBD-Wert liegt bei diesem Produkt unter 0,5 mg/ml. Die Gesamtwirkstoffmenge pro Tropfflasche beträgt hier 625 mg THC und <12,5 mg CBD.
Bei „THC10:CBD10“ liegen die THC- und CBD-Wert jeweils bei 10 mg/ml. Hier beträgt die Gesamtwirkstoffmenge 250 mg THC und 250 mg CBD. Beide Extrakte sind raffiniert in Traubenkernöl und werden in einer weißen PET-Flasche mit Pipette geliefert und dienen der oralen Anwendung. Die Tropfen sind seit Oktober 2017 im Handel.
Die Produkte sind Rezepturarzneimittel. Sie müssen vor Abgabe an den Patienten gemäß Apothekenbetriebsordnung (ApBetrO) auf Identität geprüft werden. Der Kläger warf Tilray vor, dass die Extrakte nicht den Anforderungen eines Rezepturarzneimittels, sondern vielmehr den eines Arzneimittels entsprechen würden. Die gesamte Aufmachung des Produkts einschließlich des Produktflyers und der Verpackung – bestehend aus einer PET-Flasche einschließlich patientengerechter Pipette und kindersicherem Verschluss – würden für eine Einordnung als Fertigarzneimittel im Sinne des Arzneimittelgesetzes (AMG) sprechen. Bemängelt wurde außerdem, dass die Präparate laut Produktinformationen der Beseitigung/Verminderung körperlicher Beschwerden, insbesondere bei schwerstkranken Schmerzpatienten, dienen sollen. Hier liege eine therapeutische Zweckbestimmung vor.
Das OLG gab dem Kläger Recht. Falls die Mängel vom Hersteller nicht beseitigt werden beziehungsweise keine Arzneimittelzulassung vorlege, sollten die Cannabis-Tropfen vom Markt verschwinden. Ins Visier nahmen die Richter unter anderem den kindersicheren Verschluss. Denn für die Herstellung einer Rezeptur durch einen Apotheker wäre er ihrer Ansicht nach obsolet. „Ebenso wenig benötigt ein Apotheker die Angabe Dosiereinheiten (‚Tropfen‘), um in die Lage versetzt zu werden, ein Rezepturarzneimittel herzustellen”, heißt es weiterhin im Urteil.
Das Gericht untermauerte seine Entscheidung außerdem damit, dass das Präparat „THC25” bereits exakt der Zielkonzentration eines Rezepturarzneimittels mit Dronabinol gemäß dem Neuen Rezeptur-Formularium (NRF) entspricht. Das in Bezug gebrachte Dronabinol (25 mg/ml) wird von Bionorica vertrieben und muss gemäß NRF 22.8. hergestellt werden. Die Tilray-Tropfen bedürfen den Richtern zufolge keine Herstellungsschritte mehr, um ein Arzneimittel mit der entsprechenden Zielkonzentration zu erhalten, da es sich hierbei um ein „im Voraus” hergestelltes, in abgabefertiger Flaschenform an Großhändler geliefertes Arzneimittel handele.
Das OLG berief sich bei seiner Entscheidung auf die Unterschiede: Bei Rezepturarzneimitteln beginne die Herstellung erst dann, wenn eine ärztliche Anweisung zur Herstellung dieses konkreten Arzneimittels vorliege. Außerdem würden Rezepturarzneimittel nicht für eine abstrakte, sondern für eine konkrete Anwendung hergestellt. Die Zusammensetzung der Wirkstoffe, Stärke und Darreichungsform würden vom Arzt individuell bestimmt und begründet. Die Richter haben auch darauf hingewiesen, dass auch sogenannte „Präsentationsarzneimittel” zu den Arzneimitteln gehören und die Tilray-Extrakte aus ihrer Sicht in diese Gruppe fallen.
„Die auf dem deutschen Markt befindlichen Vollspektrum Cannabisextrakte sind Bulk-Arzneimittel zur Herstellung von Rezepturarzneimitteln. Vor Markteintritt sind die Produkte von allen zuständigen deutschen Überwachungsbehörden aufwändig und vollständig geprüft und genehmigt worden entsprechend der Vorgaben des Arzneimittelgesetzes (AMG) und des Betäubungsmittelgesetzes (BtMG). Im Zuge dessen wurden auch die Herstellungsprozesse GMP-zertifiziert und damit die Qualität der Produkte von unabhängiger Stelle bestätigt”, erklärt der Hersteller. Dass es sich bei den Tilray-Produkten um Bulkware und damit um Rezepturarzneimittel handele, sei durch die staatlichen Regulierungsbehörden bestätigt worden.
Tilray hat eine Unterlassungserklärung abgegeben und die Mängel beseitigt, um „eine weitere Belieferung von Apotheken und Großhändlern sicherzustellen und den Kunden die nötige Rechtssicherheit zu bieten”. Die im Verfahren bemängelte Abgabekarte mit den betroffenen Abbildungen werde seit dem nicht mehr weiter verwendet und die Aufmachung der Extrakte entsprechend angepasst. Der Hersteller strebt eine abschließende rechtliche Klärung des Falles in einem wettbewerbsrechtlichen Hauptsacheverfahren an.
Für Apotheken und Patienten hat sich in der Zwischenzeit durch das Urteil nichts verändert. Die Cannabisextrakte sind weiterhin erhältlich und werden auf einem Betäubungsmittelrezept verordnet. Vor Abgabe müssen sie auf Identität geprüft werden. Die Anforderungen hierfür sind in der ApBetrO geregelt. Bei der Feststellung der Identität sind Methoden des Arzneibuches zu nutzen. Alternativ können andere Prüfmethoden herangezogen werden, solange die gleichen Ergebnisse erzielt werden. Die Prüfung der Cannabis-Vollextrakte kann analog der DAC-Monographie „Eingestelltes, raffiniertes Cannabisölharz“ (C-054) erfolgen. Dabei müssen bei der Prüfung auf Identität die Vorschriften nach B und C berücksichtigt werden. Beide Prüfungen stellen dünnschichtchromatographische Analysen (DC) dar.
Das Rezept mit solchen Cannabis-haltigen Zubereitungen werden mit der Sonder-PZN 06460665 bedruckt. Für das Rezepturarzneimittel wird ein Festzuschlag von 8,35 Euro gemäß § 5 Arzneimittelpreisverordnung (AMPreisV) abgerechnet. Weiterhin wird ein Festzuschlag von 90 Prozent auf die Apothekeneinkaufspreise ohne Umsatzsteuer für Stoffe und erforderliche Verpackung, ein Rezepturzuschlag sowie die Umsatzsteuer erhoben. Allerdings wird auch auf das Rezepturhonorar der Kassenabschlag von 1,77 Euro fällig. Die Kassen zahlen für das Betäubungsmittelrezept 2,91 Euro einschließlich Mehrwertsteuer.
Wie würde das Apothekenhonorar aussehen, wenn die Tropfen als Fertigarzneimittel auf dem Markt wären? „Bei der Abgabe von Fertigarzneimitteln, die zur Anwendung bei Menschen bestimmt sind, durch die Apotheken sind zur Berechnung des Apothekenabgabepreises ein Festzuschlag von 3 Prozent zuzüglich 8,35 Euro zuzüglich 16 Cent zur Förderung der Sicherstellung des Notdienstes sowie die Umsatzsteuer zu erheben”, heißt es in § 3 AMPreisV.
Die Zahlen legen nahe, dass Apotheker an der Rezeptur mehr verdienen als bei einer Abgabe als Fertigarzneimittel. Doch in der Apothekerschaft wird die Höhe des aktuelle Rezepturzuschlags trotz der Honorarerhöhung im vergangenen Jahr im Zuge des Arzneimittel-Versorgungsstärkungsgesetzes (AM-VSG) als unzureichend angesehen, da die Identitätsprüfungen sehr aufwendig und die entsprechenden Honorare nicht kostendeckend sind.




































APOTHEKE ADHOC Debatte