USA: Naloxon soll OTC werden
In den USA ist kein Ende der Opioid-Krise in Sicht. Von 2010 bis 2017 hat sich die Zahl der Todesfälle aufgrund von Überdosierungen auf 48.000 beinahe verdoppelt. Die US-Arzneimittelbehörde FDA versucht an allen Fronten, der Krise Herr zu werden. Aktuell soll der Zugang zum lebensrettenden Naloxon erleichtert werden. Auf der Agenda der Behörde steht die Entlassung des Wirkstoffs aus der Verschreibungspflicht.
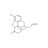
Naloxon wirkt als kompetetiver Antagonist am Opioid-Rezeptor und kann bei einer akuten Opioidvergiftung eingesetzt werden. Rechtzeitig angewendet, können Folgeschäden und Todesfälle durch einen Atemstillstand infolge einer Überdosierung verhindert werden. Naloxon kann den Missbrauchssymptomen üblicherweise binnen weniger Minuten entgegenwirken. Aus Sicht der FDA kann ein erleichterter Zugang zum Opioid-Antagonisten bei schnellem Einsatz die Zahl der Todesfälle reduzieren. Prävention und Behandlung von Opioid-Überdosierungen hätten oberste Priorität.
Eine Möglichkeit, den Zugang zu Naloxon zu erleichtern, ist dessen Entlassung aus der Verschreibungspflicht. „Die breite Verfügbarkeit von Naloxon, beispielsweise als zugelassenes OTC-Arzneimittel, ist ein wichtiger Fortschritt für die öffentliche Gesundheit“, schreibt die Behörde. Die Notwendigkeit einer ärztlichen Verordnung sei für einige Betroffene aus Scham oder Furcht vor möglichen Konsequenzen ein Hindernis. Außerdem seien nicht alle Betroffenen in ärztlicher Behandlung.
Doch der OTC-Switch ist an verschiedene Anforderungen geknüpft. So müssen Pharmaunternehmen verbraucherfreundliche Drug-Facts-Label (DFL) erarbeiten, wie sie bei OTC-Arzneimitteln gefordert sind. Außerdem müssen Studien beigebracht werden, die zeigen, dass Verbraucher wissen, wie das Arzneimittel ohne ärztliche Hilfe angewendet wird. Einige Unternehmen sehen vor allem die Durchführung der Studien als großes Hindernis, ein OTC-Naloxon auf den Markt zu bringen.
In Zeiten der Krise hat die FDA zum ersten Mal proaktiv ein DFL-Modell – für ein Naloxon-Nasenspray und einen Naloxon-Autoinjektor – entwickelt, getestet und validiert. Die Behörde will so den Herstellern einen Anreiz bieten, in den OTC-Markt einzusteigen und Naloxon breit verfügbar zu machen. „Wir haben eine Musterkennzeichnung mit leicht verständlichen Piktogrammen zur Arzneimittelanwendung erarbeitet. Außerdem haben wir Tests durchgeführt, die sicherstellen, dass das Etikett verstanden und die Anweisungen einfach befolgt werden“, schreibt die FDA. Eine der Schlüsselkomponenten für die OTC-Verfügbarkeit sei nun erfüllt.
Das Verständnis der Konsumenten wurde an 700 potentiellen Naloxon-Nutzern untersucht. Unter den Teilnehmern waren Heroinkonsumenten, Opioid-Patienten sowie deren Familien, Freunde und unbeteiligte Personen. „Neben der Zulassung von injizierbarem Naloxon für die Anwendung im Gesundheitswesen sowie von verschreibungspflichtigen Autoinjektoren und intranasalen Formen von Naloxon, die die Anwendung durch Laien erleichtern, haben wir auch Richtlinienentwürfe veröffentlicht, die die Entwicklung eines generischen Nasensprays mit Naloxonhydrochlorid vorantreiben sollen.“
Naloxon kann ausschließlich Opioid-Überdosen kurzzeitig aufheben, macht den Notarzt aber nicht überflüssig. Mit dem Nasenspray erhoffen sich Suchtexperten eine breitere Anwendung. In den USA beispielsweise haben es viele Polizisten dabei.




























APOTHEKE ADHOC Debatte