Plan B: Vaprino-Granulat ab 12 Jahren
Antiallergika könnten demnächst mehr Platz in der Sichtwahl beanspruchen: Nach Fluticason soll auch Mometason zur Behandlung der allergischen Rhinitis rezeptfrei werden. Über einen entsprechenden Antrag entscheidet am Dienstag der Sachverständigenausschuss für Verschreibungspflicht. Auch über Metronidazol zur Behandlung der Rosacea und eine Alternative für das Durchfallmittel Vaprino (Racecadotril) für Jugendliche wird gesprochen.
Beclometason gibt es bereits seit Jahren als Nasenspray in der Sichtwahl; der Wirkstoff wurde 1997 aus der Verschreibungspflicht entlassen. Den Markt teilen sich Ratioallerg (Ratiopharm) und Otri-Allergie (Novartis). Im vergangenen Jahr war mit Fluticason ein weiteres Glucocorticoid zur nasalen Anwendung aus der Verschreibungspflicht entlassen worden.
Mometason ist laut Arzneiverordnungsreport 2014 (AVR) das mit weitem Abstand führende Glucocorticoid zur nasalen Anwendung. Nasonex von MSD Sharp & Dohme wurde demnach 2013 knapp 1,8 Millionen Mal für insgesamt 29,5 Millionen Euro zulasten der Kassen verordnet. Zweitgrößter Wirkstoff ist laut AVR Budesonid.
Der Antrag zum OTC-Switch bezieht sich auf die „nasale Anwendung zur symptomatischen Behandlung der saisonalen allergischen Rhinitis bei Erwachsenen und Kinder ab 12 Jahren in einer Einzeldosis von 200 Mikrogramm“.
Außerdem befassen sich die Experten mit Metronidazol, dass in Zubereitungen zur Anwendung auf der Haut bei papulopustulöser Rosacea vom Subtyp II bei Erwachsenen in Konzentrationen von maximal 0,75 Prozent Metronidazol rezeptfrei werden soll.
Die am häufigsten abgegebenen Metronidazol-Produkte bei den antibiotikahaltigen Dermatika sind Metrogel, -creme und -lotion von Galderma. Sie wurden 2013 rund 310.000 Mal für 6,4 Millionen Euro zulasten der Kassen abgegeben. An zweiter Stelle folgt Rosiced von Pierre Fabre mit 150.000 Verordnungen zu insgesamt 2,2 Millionen Euro. Metrosa von Dr. August Wolff folgt mit 19.000 Verordnungen für 280.000 Euro auf Platz 3.
Einen zweiten Anlauf nimmt Boehringer Ingelheim in Sachen Vaprino für Jugendliche: Nach dem OTC-Switch für das Erwachsenenpräparat im Jahr 2012 hatte der Sachverständigenausschuss im Juli die Freigabe für Kinder und Jugendliche ab fünf Jahren verweigert. Ursprünglich hatte Boehringer versucht, das Präparat in der Dosis 30 Milligramm und in Packungen mit bis zu 18 Kapseln für eine maximale Anwendungsdauer von drei Tagen für diese Zielgruppe zu öffnen. Parallel sollte immer eine orale Rehydration erfolgen.
Auch ein alternativer Vorschlag eines Vertreters des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) wurde damals abgelehnt: Demnach hätte der Wirkstoff für Kinder ab dem vollendeten 12. Lebensjahr aus der Rezeptpflicht entlassen werden sollen. Der Kompromiss scheiterte aber zuletzt an Gewichtsproblemen: Die Dosierung ab zwölf Jahren beträgt 60 Milligramm als Einzeldosis. Das entspricht einem Körpergewicht von 40 Kilogramm. Die Experten wandten ein, dass dies im Alter von zwölf Jahren nicht der Regelfall sei.
Nun schlägt der Hersteller einen anderen Weg ein. Der Wirkstoff soll bei Kindern ab dem vollendeten 12. Lebensjahr und mindestens 27 Kilogramm Körpergewicht in Konzentrationen von 30 mg je abgeteilter Form zur Herstellung einer Suspension und in einer Gesamtmenge von bis zu 540 mg je Packung aus der Verschreibungspflicht entlassen werden. Das entspricht einer Anwendungsdauer von maximal drei Tagen. Der Partner des Pharmakonzerns, der französische Hersteller Bioprojet, hat bereits eine Zulassung für die Granulatbeutel in der Tasche.
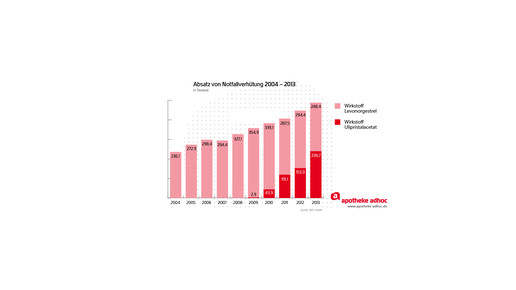
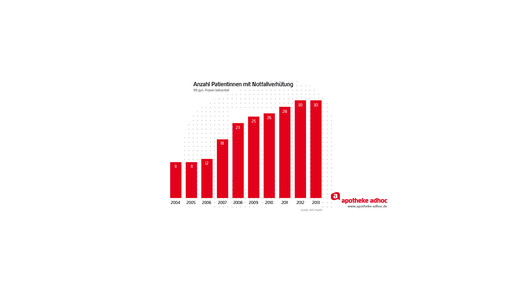
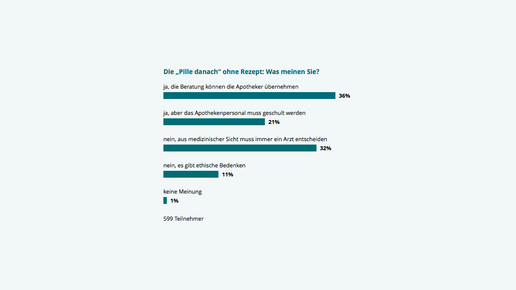
Außerdem könnte sich der Sachverständigenausschuss mit der Entscheidung der EU-Kommission zu EllaOne (Ulipristal) beschäftigen und eine Empfehlung zu Notfallkontrazeptiva mit Levonorgestrel und Ulipristal treffen. Das ist nötig, damit sich Bundesregierung und Bundesrat mit einer Änderung der Arzneimittelverschreibungsverordnung (AMVV) befassen können.
















































APOTHEKE ADHOC Debatte