Liebestanz der Rezeptoren Deniz Cicek-Görkem, 26.10.2017 13:25 Uhr
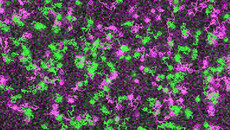
Rezeptoren im Livestream: Wissenschaftler der Julius-Maximilian-Universität (JMU) in Würzburg haben erstmals Rezeptoren live beobachtet. Sie haben zudem herausgefunden, dass sich diese Bindungsstellen mit den jeweiligen für die Signalübertragung wichtigen G-Proteinen an bestimmten Orten auf der Plasmamembran „treffen“. Die Studie wurde im Fachjournal „Nature“ publiziert.
Damit die Signaltransduktion der G-Protein-gekoppelten Rezeptoren (GPCR) beginnen kann, ist vorher eine Wechselwirkung von Rezeptoren und G-Proteinen erforderlich. Bislang war unbekannt, wie und wo die Interaktion stattfindet. Forscher der Universitäten in Würzburg, Birmingham und Wrocław ist es nun gelungen, dieser Frage erfolgreich nachzugehen. Sie konnten erstmals das „Netzwerken“ zwischen den einzelnen Rezeptoren und ihren G-Proteinen beobachten und analysieren. Als Modell-Rezeptor diente der α2A-adrenerge Rezeptor (α2A-AR) aus der Familie A der GPCR.
„Wir konnten zeigen, dass Rezeptoren und G-Proteine sich bevorzugt an speziellen Orten auf der Plasmamembran treffen, die wir als ‚Hot Spots‘ bezeichnen“, erklärt Professor Dr. Davide Calebiro, Hauptautor der Studie. Calebiro forscht am Institut für Pharmakologie und Toxikologie und am Bio-Imaging Center der Universität Würzburg sowie am Centre of Membrane Proteins and Receptors der Universitäten von Birmingham und Nottingham. Außerdem konnten die Wissenschaftler sehen, dass Rezeptoren und G-Proteine in der Regel nur vorübergehend miteinander in Kontakt stehen. Die Interaktion dauerte in den meisten Fällen nur eine Sekunde.
Bei der Bildung der Hot Spots spielen den Ergebnissen zufolge das Zytoskelett sowie andere strukturelle Komponenten der Zellmembran (clathrin-coated pits) eine bedeutende Rolle. Die Forscher bemerkten während der Experimente, dass Rezeptoren und G-Proteine in Nanodomänen konzentriert werden. Ihrer Meinung nach beeinflussen Hot Spots die Aktivierung der G-Proteine, indem sie die Geschwindigkeit und die Effizienz dieser Prozesse steigern. Gleichzeitig sorgen diese Treffpunkte auf der Zelloberfläche dafür, dass die Signaltransduktion räumlich beschränkt werden kann. „Anscheinend können einfache biologische Prozesse äußerst komplex sein, wenn man sie aus der Nähe betrachtet“, bewerten die Wissenschaftler das Ergebnis.
Die Interaktion konnte mittels interner Totalreflexionsfluoreszenzmikroskopie (TIRF) visualisiert werden. Die Forscher gehen davon aus, dass die Fortschritte in den bildgebenden Verfahren zu einem detaillierterem Verständnis der Signalwege führen werden – was notwendig für die Entwicklung neuartiger Behandlungsoptionen ist. Ihre Studienergebnisse bieten Perspektiven: „Bisher gängige Wirkstoffe arbeiten so, dass sie die Rezeptoren entweder blockieren oder aktivieren“, erklärt Calebiro. Künftig könnte es möglich sein, selektiver auf diese Prozesse einzuwirken – beispielsweise indem man die Mobilität von Rezeptoren und G-Proteinen auf der Zellmembran oder deren Interaktionen an den Hot Spots manipuliert.
GPCR gehören zu den membranständigen Rezeptoren. Ihre Aufgabe besteht darin, das von den Transmittern ausgehende Signal vom Zelläußeren in das Zellinnere zu übertragen. Dabei führt die Ligandenbindung zur Aktivierung Rezeptor-assoziierter G-Proteine, indem eine Konformationsänderung induziert wird. Die G-Proteine bestehen aus drei funktionellen Einheiten, die als Gα, Gβ und Gγ bezeichnet werden.
Die biologischen Wirkungen vieler Hormone und Neurotransmitter werden über GPCR vermittelt, außerdem sind sie wichtige pharmakologische Targets. Heute greifen rund die Hälfte aller verschreibungspflichtigen Medikamente an diesen Rezeptoren an, beispielsweise Antihistaminika, Triptane sowie Opioide.