HDAC-Inhibitoren: Krebszellen töten, gesunde Zellen schonen APOTHEKE ADHOC, 24.10.2018 11:07 Uhr
Chemotherapeutika greifen auch gesunde Körperzellen an, was sich in unerwünschten Arzneimittelwirkungen wie Haarausfall, Nagelschäden und Schleimhautproblemen bemerkbar macht. Wenn im Rahmen der Therapie nur bösartige Zellen getötet und gesundes Gewebe nicht angegriffen würden, könnten derartige und andere Nebenwirkungen wahrscheinlich vermieden werden. Die Arbeitsgruppe um Professor Dr. Oliver Krämer vom Institut für Toxikologie der Universitätsmedizin Mainz hat nun vielversprechende Ergebnisse mit Inhibitoren der Histon-Deacetylasen (HDAC) erzielt. Die Forschungsergebnisse wurden in mehr als 40 Fachjournalen veröffentlicht, darunter „Archives of Toxicology” und „Nature Communications”.
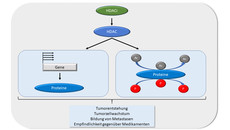
Der aktuelle Stand der Wissenschaft besagt, dass Tumorzellen gegenüber gesunden Zellen eine veränderte Markierung von wichtigen körpereigenen Proteinen mit sogenannten Acetylresten aufweisen. Diese Molekülstrukturen modifizieren Histon-Proteine, die einen Einfluss auf die Transkription haben. Außerdem beeinflussen sie die Funktion von Proteinen, die für die Zellproliferation von Bedeutung sind. Dieser Prozess unterliegt der Enzymfamilie der HDAC, die 18 Proteine umfasst. In Krebszellen sind HDAC häufig fehlreguliert, die Markierung von Proteinen mit Acetylresten ist dementsprechend gestört. Substanzen, die diese Enzyme hemmen, können das Wachstum und das Überleben von Krebszellen reduzieren. Sie verändern unter anderem Eiweißbausteine an der DNA, haben aber keinen Einfluss auf die Abfolge der Basenpaare.
Wissenschaftler gehen deshalb davon aus, dass entartete Zellen von der Dysbalance der Acetylreste abhängig sind. Hier knüpfen die Forschungen von der Arbeitsgruppe um Krämer an. Der Professor forscht seit 2001 zu den HDAC-Inhibitoren und analysiert zusammen mit seinem Team die für die Tumorgenese relevanten Proteine in Bezug auf ihre Acetylierung, Phosphorylierung und Ubiquitinylierung. Ihr Ziel ist es, mithilfe von Hemmstoffen die Acetylierungsmuster in Krebszellen so verändern, dass diese zerstört werden. Gegen einzelne Mitglieder der HDAC konnte die Forschergruppe nun neue Erkenntnisse erzielen. Sie setzten bei ihren Experimenten mit Zelllinien und Labortieren die Arzneistoffe Valproinsäure, Entinostat, Romidepsin, Panobinostat und Marbostat-100 ein. Mittels HDAC-Inhibitoren konnten sie beispielsweise die Kontrolle über den Zellzyklus der Darmkrebszellen entziehen und damit eine Vermehrung der Tumorzellen stoppen.
Die Forscher fanden heraus, dass HDAC1 und HDAC die Synthese eines Proteins namens PR130 unterdrücken. Die HDAC-Inhibitoren bewirken dessen Akkumulation in entarteten Zellen. Dies soll den Ergebnissen zufolge entscheidend dafür sein, ob Tumorzellen nach der Behandlung mit Chemotherapeutika Zellzyklus-Kontrollpunkte aktivieren können. „HDAC-Inhibitoren können Krebszellen überlisten: Sie merken nicht, dass sie Stress durch Chemotherapeutika haben, reagieren daher nicht adäquat und sterben ab“, erklärt Krämer. Darüber hinaus haben die Wissenschaftler festgestellt, dass die Hemmstoffe Reparaturmechanismen der DNA in Krebszellen außer Gefecht setzen und diese dadurch empfindlicher für DNA-schädigende Chemotherapien machen können.
In einem weiteren Projekt zeigen die Forscher, dass HDAC-Inhibitoren das Wachstum von Nierenkrebszellen und deren Metastasierung in das Lungengewebe deutlich verringern. In Zusammenarbeit mit Dr. Falk Butter vom Institute of Molecular Biology in Mainz konnten sie an mehr als 5000 in Krebszellen exprimierten Proteinen beobachten, dass HDAC-Inhibitoren in der Lage sind, komplexer Gen- und Proteinmuster in Nierenkrebszellen so zu modulieren, dass diese in den Zelltod getrieben werden. Weiterhin haben sie entdeckt, dass HDAC2 eine wichtige Rolle beim individuellen Ansprechen auf die Krebstherapie zu spielen scheint. Das Protein ist in vielen Tumorzellen fehlreguliert, was zu einer Inaktivierung des Tumorsuppressorgens p53 führt. Folgen sind schnelle Entartung der Zellen und eine erhöhte Widerstandsfähigkeit gegen Chemotherapeutika. Die Wissenschaftler beobachteten, dass Krebszellen aus der Bauchspeicheldrüse mit mutierten Formen von p53 gegenüber HDAC-Inhibitoren empfindlich reagieren. Dies könne therapeutisch relevant werden, da viele Tumorzellen in ihrem Überleben von entartetem p53-abhängig seien.
Die Forschungsergebnisse verdeutlichen, dass HDAC von fundamentaler Bedeutung für die Krebsentstehung und -aufrechterhaltung sind. „Umso wichtiger ist die weitere Erforschung, Entwicklung und Testung von HDAC-Inhibitoren. Denn durch ihre Fähigkeit, die Struktur von Eiweißen und die Ableserate von Genen zu verändern, die das Wachstum entarteter Zellen regulieren, können diese neuartigen Arzneistoffe wesentlich zum erfolgreichen Kampf gegen Krebs beitragen. Sie eröffnen ganz neue Therapieoptionen, indem sie dem Körper ermöglichen, bösartige Zellen gezielt abzutöten und gleichzeitig gesundes Gewebe – und damit auch die Lebensqualität der Krebskranken – zu erhalten“, fasst Krämer zusammen.
Zugelassene HDAC-Inhibitoren bei bestimmten Krebserkrankungen gibt es schon auf dem Markt. So ist in Deutschland Panobinostat (Farydak, Novartis) erhältlich und in Kombination mit Bortezomib und Dexamethason indiziert für die Behandlung erwachsener Patienten mit rezidiviertem und/oder refraktärem Multiplen Myelom, die mindestens zwei vorausgegangene Therapien, darunter Bortezomib und eine immunmodulatorische Substanz, erhalten haben. Vorinostat (Zolinza, MSD) ist in den USA seit Oktober 2006 und Romidepsin (Istodax, Celgene) seit November 2009 zur Behandlung des kutanen T-Zell-Lymphoms zugelassen. Die Europäische Arzneimittelagentur (EMA) hatte sich 2012 gegen die europäische Zulassung von Romidepsin ausgesprochen. In klinischen Studien wurden zudem auch HDAC-Inhibitoren wie ACY-1215, Belinostat und Givinostat mehr oder weniger erfolgreich bei verschiedenen Tumorzellen untersucht. Weitere Studien mit verschiedenen potenziellen Arzneistoffen dauern an.