FDA-Zulassung für Cannabidiol
Cannabidiol gegen Epilepsie: Die US-Arzneimittelbehörde FDA hat Epidiolex (GW Pharmaceuticals) die Zulassung erteilt. Damit kann das Schwesterprodukt zu Sativex auf den Markt kommen.
Epidiolex ist in den USA für die Behandlung von zwei seltenen und schweren Formen der Epilepsie zugelassen – das Lennox-Gastaut-Syndrom (LGS) und das Dravet-Syndrom. Beide Erkrankungen treten erstmalig im frühen Kindesalter auf, für die Therapie infrage kommen Patienten ab einem Alter von zwei Jahren. Der Markteintritt wird voraussichtlich im Herbst erfolgen.
Es ist das erste von der FDA zugelassene Medikament, das eine aufgereinigte Substanz der Hanfpflanze enthält. Und es ist das erste in den USA zugelassene Arzneimittel zur Behandlung des Dravet-Syndroms. Die Erkrankung wird mit einer genetischen Mutationen des Natriumkanals SCN1A in Verbindung gebracht. Patienten neigen zu prolongierten Krampfanfällen und zu einem Status epilepticus. Kinder mit dieser Krankheit haben ein erhöhtes Risiko, plötzlich und unerwartet zu sterben. Die moderaten bis schweren intellektuellen Behinderungen und Entwicklungsstörungen machen eine lebenslange Betreuung erforderlich. Patienten mit LSG leiden beispielsweise an Sturz- und Krampfanfällen und nicht-konvulsiven Anfällen.
Cannabidiol (CBD) wird im Vergleich zu Tetrahydrocannabinol (THC) keine berauschende Wirkung zugesprochen. Intoxikationen oder ein Rausch bleiben aus. Die Wirksamkeit wurde in drei randomisierten, doppelblinden, placebokontrollierten klinischen Studien mit 516 Teilnehmern bestätigt. Die Probanden waren entweder am LGS oder Dravet-Syndrom erkrankt.
Die Studien konnten zeigen, dass Epidiolex in Kombination mit anderen Medikamenten die Anfallshäufigkeit im Vergleich zu Placebo wirksam reduziert. Zu den häufigsten unerwünschten Arzneimittelwirkungen zählen Schläfrigkeit, Lethargie, Unwohlsein und Schwäche, Ausschläge oder Schlafstörungen. Eine im „Journal of Neurology, Neurosurgery and Psychiatry“ veröffentlichte Studie zeigte eine Reduktion der Anfallshäufigkeit von mindestens 50 Prozent bei behandlungsresistenter pädiatrischer Epilepsie. Die Probanden wurden mit Epidiolex zu 20 mg/kg pro Tag behandelt. Auch aktuell im „New England Journal of Medicine“ veröffentliche Studiendaten, belegen die Wirksamkeit von Epidiolex bei Epilepsie.
GW Pharmaceuticals hat auch bei der Europäischen Arzneimittelagentur (EMA) einen Zulassungsantrag für Epidiolex eingereicht. Der Antrag stützt sich auf Daten von drei Phase-III-Studien mit etwa 1500 Teilnehmern. Die Entscheidung wird für 2019 erwartet.
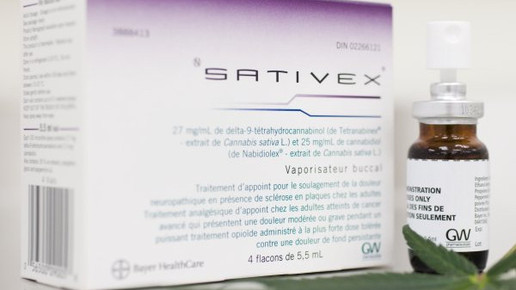
Das Unternehmen ist unter anderem Zulassungsinhaber von Sativex (Nabiximol: Cannabidiol/Tetrahydrocannabinol). Herbei handelt es sich um ein Arzneimittel auf Basis von Cannabis zur Behandlung von Spastiken im Rahmen der Multiplen Sklerose.




































APOTHEKE ADHOC Debatte