Hexal hat technische Probleme, darum muss ASS 100 zurück – betroffen ist eine Charge. Wie bereits angekündigt, findet heute der Rückruf von Zinbryta statt, da Biogen auf die Zulassung verzichtet. Die AMK-Meldungen des Tages.
ASS 100 mg Hexal, 100 Tabletten, Ch.-B.: HG3572
Technischer Defekt: Hexal ruft ASS 100 zu 100 Tabletten mit der Chargenbezeichnung HG3572 zurück. Ursache ist ein technischer Defekt, der die Lesbarkeit der Fertigarzneimittelbezeichnung auf den Blisterfolien beeinträchtigt. Diese seien möglicherweise schlecht oder nicht leserlich. Chargenbezeichnung und Verfallsdatum sind nicht betroffen.
Apotheker werden daher gebeten, das Warenlager auf die betroffene Charge zu überprüfen. Vom Rückruf betroffene Ware soll an folgende Adresse geschickt werden: Salutas Pharma GmbH, Retouren, Otto-von-Guericke-Allee 1, 39179 Barleben.
Psoradexan, 50 g und 2x50 g Creme, Ch.-B.: 646341 und 651351
Psoradexan forte, 50 g Creme, Ch.-B.: 646291
Abweichungen bei Dithranol: Almirall ruft Psoradexan und Psoradexan forte aufgrund von Gehaltsabweichungen zurück. Betroffen ist der Wirkstoff Dithranol, was eine Verfärbung mit sich bringt. Eine Auswirkung auf die Patientensicherheit wird nicht erwartet.
Apotheken werden gebeten, das Warenlager auf die betroffenen Chargen zu überprüfen und die Ware an den Großhandel zu retournieren.
Utrogestan 100 mg, Kohlpharma, 30 und 90 Weichkapseln, Ch.-B.: K016 und L001
Hersteller fehlt: Kohlpharma schließt sich dem Rückruf des Originalherstellers Dr. Kade Besins an. Dieser ruft in Spanien mehrere Chargen zurück, da der Wirkstoffhersteller nicht in der Zulassung des Präparates aufgeführt ist.
Apotheken werden gebeten, das Warenlager auf die Chargen K016 und L001 zu überprüfen und Lagerbestände an folgende Adresse zu schicken: Kohlpharma GmbH, Im Holzhau 8, 66663 Merzig.
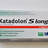
Flupirtin-Aristo 100 mg, 30, 50 und 80 Hartkapseln, alle Chargen
Rücknahme der Zulassung empfohlen: Nachdem der Ausschuss für Pharmakovigilanz (PRAC) der Europäischen Arzneimittelagentur (EMA) die Rücknahme der Zulassungen Flupirtin-haltiger Arzneimittel empfohlen hat, ruft nun auch Aristo das Generikum zurück. Ursache der Empfehlung sind Berichte zu schwerwiegenden Leberproblemen im Zusammenhang mit der Einnahme von flupirtinhaltigen Arzneimitteln. Die Empfehlung des PRAC ist jedoch noch nicht rechtskräftig.
Apotheker werden gebeten, das Warenlager auf die vom Rückruf betroffene Ware zu überprüfen und diese an den Großhandel zurückzusenden.
Zinbryta 150 mg Injektionslösung, 1 und 3 Fertigspritzen, alle Chargen
Verzicht auf Zulassung: Biogen ruft eigenverantwortlich und mit sofortiger Wirkung Zinbryta (Daclizumab) zurück. Insgesamt acht Meldungen einer immunvermittelten Enzephalitis/Enzephalopathie wurden im Zusammenhang mit Zinbryta dokumentiert – betroffen sind sieben Patienten in Deutschland und einer in Spanien. Aufgrund dieser Vorfälle verzichtet Biogen auf die Zulassung.
Apotheker werden gebeten, das Warenlager auf die betroffene Ware zu überprüfen und diese an den Großhandel zurückzuschicken. Für Fragen stehen die Großhandelsbeauftragte Tina Heiß und Elke Piller, Leitung Zulassung, unter der Telefonnummer 089 99617 0 zur Verfügung.



















APOTHEKE ADHOC Debatte