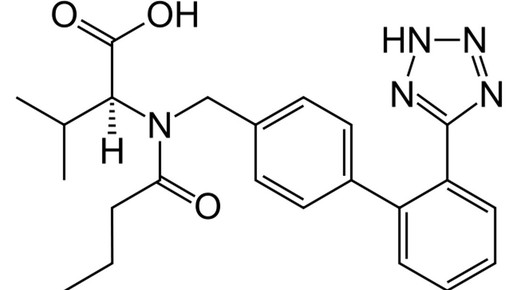
USA: Valsartan von Teva muss zurück
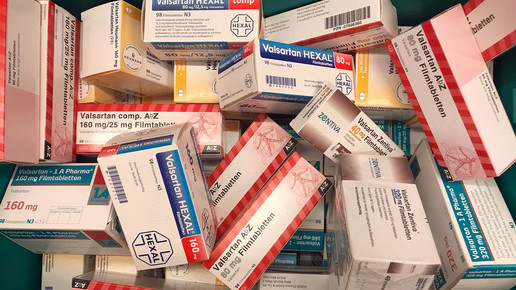
Rückruf Valsartan-haltiger Arzneimittel nun auch in den USA: Nachdem sich die US-Arzneimittelagentur FDA am Anfang der vergangene Woche nicht zur Entscheidung der Europäischen Arzneimittel äußern wollte und keinen Bedarf für einen Rückruf Valsartan-haltiger Arzneimittel sah, änderte sich das Bild. Am Freitag startete in den USA ein freiwilliger Rückruf einzelner Arzneimittel.
Valsartan-haltige Arzneimittel wurden bislang in 22 Ländern zurückgerufen – darunter neben europäischen Nationen auch Kanada und Bahrain – es sollen 2300 Chargen betroffen sein. Ursache ist die Verunreinigung des Wirkstoffes mit N-Nitrosodimethylamin (NDMA), das als möglicherweise krebserregend eingestuft wird. Das „unerwartete“ Auftreten der Verunreinigung sei vermutlich auf eine Änderung im Herstellungsprozess zurückzuführen, schreibt die FDA.
Die Gesundheitsbehörde prüfe derzeit die in den zurückgerufenen Arzneimitteln enthaltene NDMA-Konzentration. Anhand der Untersuchungsergebnisse könne das Risiko für die Patienten beurteilt werden. Die Analysen sollen außerdem zeigen, welche Maßnahmen ergriffen werden können, um zukünftig die Verunreinigung zu reduzieren oder zu eliminieren.
Vom Rückruf betroffen sind die Valsartan-Monopräparte von Major Pharmaceuticals, Solco Healthcare und Teva, sowie die Kombinationspräparte mit Hydrochlorothiazid von Solco Healthcare und Teva. „Wir haben die in den USA verfügbaren Valsartan-haltigen Arzneimittel sorgfältig untersucht und festgestellt, dass die Präparate der genannten Unternehmen nicht den Sicherheitsstandards entsprechen“, sagt Janet Woodcock, Direktorin Arzneimittelbewertung und -forschung der FDA.
Die FDA rät Patienten die Arzneimittel nicht einfach abzusetzen, sondern weiter einzunehmen, bis sie ein Ersatzprodukt erhalten haben. Patienten sollten sich an den behandelnden Arzt werden. Dieser könne ein nicht betroffenes Valsartan-haltiges Arzneimittel oder einen anderen Wirkstoff verordnen.
Die FDA sah Anfang der vergangenen Woche keinen Handlungsbedarf, einen Rückruf sollte es vorerst nicht geben. „Die FDA ist sich der EMA-Meldung bewusst, kommentiert diese derzeit jedoch nicht. Im Allgemeinen kommentiert die Agentur keine Ankündigungen von Dritten, sondern wertet sie lediglich als Beweismaterial aus, um das Verständnis für ein bestimmtes Thema zu vertiefen und den Schutz der öffentlichen Gesundheit sicherzustellen“, schrieb eine Sprecherin. Im Januar war in den USA Ware eines Herstellers zurückgerufen worden, der von Zhejiang Huahai Pharmaceutical hatte produzieren lassen. Grund waren nicht Verunreinigungen, sondern zu große Tabletten.
Entwarnung kam auch von Novartis, der Originalhersteller produziert selbst in Irland und in der Schweiz und geht auch nicht davon aus, dass die Produkte der Konkurrenz ein Gesundheitsrisiko haben: „Die im Valsartan nachgewiesene Menge N-Nitrosodimethylamin ist geringer als die kumulative endogen Produktion und die übliche Exposition mit der Substanz“, wird Eric Althoff von CNN zur Lage in den USA zitiert. Man könne nicht genau sagen, wie groß das potenzielle Krebsrisiko der Verunreinigung sei. „Somit würde die Menge, die im Wirkstoff gefunden wurde, für die Patienten kein signifikant erhöhtes Gesundheitsrisiko darstellen.“ Die Aussage hatte sich leider nicht bewahrheitet.






























APOTHEKE ADHOC Debatte